
向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反應(不考慮CO2的溶解),下列說法不正確的是
A. 當a≥2b時,發生的離子反應為:2OH-+CO2=CO32-+H2O
B. 當a=1.25b時,發生的離子方程式為:5OH-+4CO2=3HCO3-+CO32-+H2O
C. 2b/3<a<2b時,溶液中CO32-與HCO3-物質的量之比為:(2b-a):(2a-b)
D. 若反應后溶液中CO32-與OH-物質的量之比為2:1,則5b=a
科目:高中化學 來源:2015-2016學年吉林省高二下學期基礎訓練(15)化學試卷(解析版) 題型:選擇題
阿伏加德羅常數用NA表示,下列敘述正確的是
①22g T2O含有電子數為10 NA
②0.44gC3H8中含有的σ鍵總數目為0.1NA
③1 mol Na2O2與CO2完全反應時轉移電子數為2NA
④28 g 硅晶體中含有2 NA個Si—Si鍵
⑤11.2LCl2通入足量氫氧化鈉溶液中充分反應,轉移的電子數等于0.5NA
⑥200 mL,1 mol/L Al2(SO4)3溶液中,Al3+和SO42-離子數的總和是NA
⑦在常溫常壓下,0.1mol鐵與0.1mol Cl2充分反應,轉移的電子數為0.3 NA
⑧O2和O3的混合物共6.4g,其中所含原子數一定為0.4 NA
A. ①②③⑤⑧ B. ②④⑥⑦⑧ C. ①③⑤⑥⑦ D. ①②④⑧
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省衡陽市高二理科實驗班下學期第一次月考理綜化學試卷(解析版) 題型:實驗題
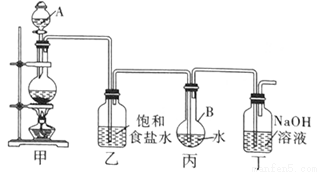
(1)寫出裝置甲中發生反應的化學方程式: 。
裝置甲中的儀器使用前需要檢漏的有 (寫名稱)。
(2)利用裝置丙制取飽和氯水并測其pH值。
①證明氯水已飽和的現象是 。
②測定飽和氯水的pH方法是 。
③若撤去裝置乙,直接將裝置甲和丙相連。這樣做對實驗測定結果的影響是 。
(3)飽和氯水與石灰石的反應是制取較濃的HClO溶液的方法之一。某同學運用這一方法,嘗試制取HClO溶液并進行了如下定性實驗:
i.在試管中加入過量的塊狀碳酸鈣,再加入約20ml飽和氯水,充分反應,有少量氣泡產生,溶液的黃綠色褪去;
ii.過濾,將濾液滴在有色布條上,發現其漂白性更強;
iii.為了確定反應產物,將濾液分為三份,分別進行以下實驗:
第一份與石灰水混合,立即產生大量白色沉淀;
第二份與稀鹽酸混合,立刻產生大量氣泡;
第三份加熱,看到溶液變渾濁且有大量無色氣體產生。
經檢測,上述實驗中產生的無色氣體均為CO2氣體。
② 試解釋可以在飽和氯水中加入石灰石制備HClO的原因: 。(用有關的方程式結合文字回答)
②試根據所學知識推測,在ii的濾液中含有的溶質,除了溶解的極少量氯氣外,還含有的其他溶質為 (寫化學式)。
③寫出步驟iii中第一份濾液發生反應的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源:2017屆河南省天一大聯考高三階段性測試(四)(b卷)理綜化學試卷(解析版) 題型:選擇題
下列實驗過程中的現象及結論均正確,且存在因果關系的是
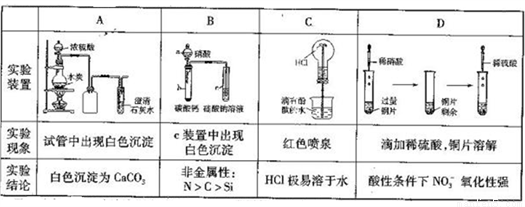
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:浙江省衢州市2017屆高三1月教學質量檢測化學試卷 題型:計算題
鐵粉、銅粉混合物樣品11.6g,逐步加入2.0 mol/L,的硫酸溶液,充分反應后剩余固體質量隨加入硫酸溶液體積變化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固體/g | 9.36 | 7.12 | 4.88 | 3.20 |
請回答:
(1)樣品中鐵與銅的物質的量之比n(Fe):n(Cu)=________ 。
(2)在反應后的體系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反應后溶液中存在的各金屬離子的物質的量分別是多少?__________________
查看答案和解析>>
科目:高中化學 來源:浙江省衢州市2017屆高三1月教學質量檢測化學試卷 題型:選擇題
已知甲烷和汽油(可用C8H18表示)的燃燒的熱化學方程式:
CH4(g)+2O2(g)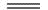 CO2(g)+2 H2O(l) △H=-890 kJ • mol﹣1;
CO2(g)+2 H2O(l) △H=-890 kJ • mol﹣1;
C8H18(l)+12.5 O2(g)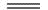 8CO2(g)+9H2O(l) △H=-5472 kJ • mol﹣1;
8CO2(g)+9H2O(l) △H=-5472 kJ • mol﹣1;
某學校食堂擬選用天然氣作為供熱燃料,下列選擇依據不正確的是
A. 等質量的汽油和甲烷燃燒,甲烷產生的熱量比汽油多,因此甲烷更高效
B. 產生相同熱量所生成的二氧化碳,汽油比甲烷多,因此甲烷更低效
C. 甲烷含碳量低,燃燒更充分,不易積炭,不易產生CO,因此更環保
D. 等物質的量的汽油和甲烷燃燒,汽油產生的熱量比甲烷多,因此更環保
查看答案和解析>>
科目:高中化學 來源:浙江省衢州市2017屆高三1月教學質量檢測化學試卷 題型:選擇題
一定條件下,0.3molX(g)與Y(g)在容積固定的密閉容器中發生反應:X(g)+3Y(g)  2Z(g), ΔH=-aKJ/mol,下列說法正確的是
2Z(g), ΔH=-aKJ/mol,下列說法正確的是
A. 反應一段時間后,X與Y的物質的量之比仍為1:1
B. 達到平衡時,且反應放出0.1aKJ的熱量
C. 達到平衡后,若向平衡體系中充入西游氣體,Z的正反應速率將不發生變化
D. X的體積分數保持不變,說明反應已達到平衡
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省南京市高二學業水平模擬測試化學試卷(解析版) 題型:選擇題
反應2NaClO3+Na2SO3+H2SO4===2ClO2↑+2Na2SO4+H2O可制備高效消毒劑ClO2。對于該反應的說法正確的是
A. NaClO3被氧化 B. Na2SO3是還原劑
C. H2SO4是氧化劑 D. 每生成1 mol ClO2轉移2 mol電子
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省“江南十校”高三3月聯考理綜化學試卷(解析版) 題型:選擇題
高鐵電池是一種可充電電池,其設計圖如下所示:負極材料是Zn,氧化產物是Zn(OH)2,正極材料是K2FeO4(易溶鹽),還原產物是Fe(OH)3,電解質溶液是KOH水溶液。下列有關說法正確的是
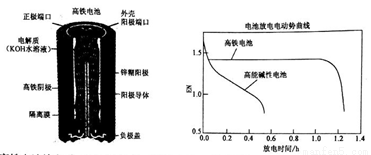
A. 高鐵電池放電時正極反應為:Zn+2OH--2e-=Zn(OH)2
B. 高鐵電池充電時陰極反應為Fe(OH)3+5OH--3e-=FeO42-+4H2O
C. 高鐵電池放電時的總反應為:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. 高能堿性電池比高鐵電池工作電壓更穩定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com