
I. 為比較Cl2、Fe3+、SO2的氧化性,用下圖所示裝置進行實驗,其過程如下:
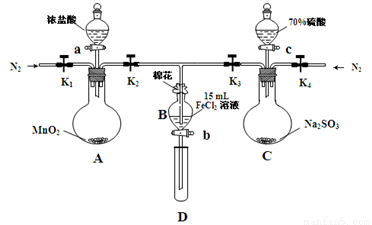
①.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,然后關閉K1、K3、K4。
②.打開活塞a,滴加一定量的濃鹽酸,給A加熱。
③.當B中的溶液變黃時,停止加熱,夾緊彈簧夾K2。
④.打開活塞b,使約2mL的溶液流入D試管中,檢驗其中的離子。
⑤.打開彈簧夾K3、活塞c,加入70%的硫酸,一段時間后夾緊彈簧夾K3。
⑥.更新試管D,重復過程④,檢驗B溶液中的離子。
(1)棉花中浸潤的溶液為__________。
(2)當A中足量固體加入36.5%密度為1.2g/mL鹽酸100mL時,其反應轉移的電子數目為______。
(3)過程⑥中檢驗B溶液中是否含有硫酸根離子的操作是___________。
(4)甲、乙、丙三位同學分別完成了上述實驗,他們的檢測結果一定能夠證明氧化性的是____同學,其氧化性順序為____________。
過程④ B溶液中含有的離子 | 過程⑥ B溶液 中含有的離子 | |
甲 | 有Fe3+無Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+無Fe2+ | 有Fe2+ |
II. NaNO2是重要的防腐劑,+3價的氮易發生氧化反應且在酸性環境中不穩定。其5mol/L水溶液pH為9。某化學興趣小組設計如下圖所示裝置制備亞硝酸鈉。其操作是①關閉彈簧夾,打開A中分液漏斗活塞,滴加一定量濃硝酸,加熱;②一段時間后停止加熱。回答下列問題:
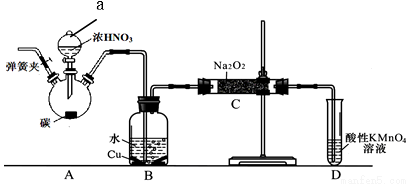
(1)B中觀察的主要現象是__________,D裝置的作用是____________。
(2)檢驗C中產物有亞硝酸鈉的操作是_______,相應反應方程式為___________。
(3)經檢驗C中產物亞硝酸鈉含量較少。a. 甲同學認為C中產物不僅有亞硝酸鈉,還有其他雜質。為排除干擾,甲在B、C裝置間增加裝置E,E中盛放的試劑是_______(寫名稱)。b. 乙同學認為除上述干擾因素外,還會有氧氣參與反應導致產品不純,所以在實驗操作①前應增加一步操作,該操作是___。
(4)由題給條件計算HNO2的Ka數值為______________。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年黑龍江省高二下學期開學考試化學試卷(解析版) 題型:選擇題
向甲、乙兩個容積均為1L的恒容容器中分別充入2 mol
A. 2 molB和1 molA、l mol B。相同條件下發生如下反應:A(g)+B(g) xC(g) ∆H<0。測得兩容器中
xC(g) ∆H<0。測得兩容器中 隨時間t的變化如圖所示。下列說法錯誤的是 ( )
隨時間t的變化如圖所示。下列說法錯誤的是 ( )
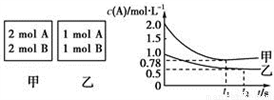
A.x可能等于2也可能等于3
B. 若向平衡后的乙容器中充入C,則再次達到平衡時A 的體積分數減小
C. 單獨升高甲容器的溫度,可使甲容器中各物質的體積分數與乙容器相同
D. 若其它條件不變,使乙容器體積變為2L,則平衡時乙容器中:0.25mol?L-1<c(A)<0.5mol?L-1
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一下學期第一次模塊考試化學試卷(解析版) 題型:選擇題
學習化學過程中需要經常做實驗。下列實驗操作正確的是 ( )
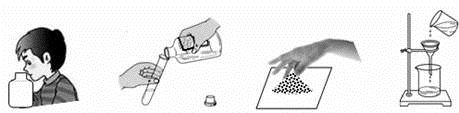
A. 聞氣味 B. 傾倒液體 C. 取粉末 D. 過濾
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省大連市高二上學期期末考試(理)化學試卷(解析版) 題型:選擇題
常溫下,0.05 mol/L的Ba(OH)2溶液,pH為
A. 12.7 B. 13.0 C. 12.0 D. 13.7
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省大連市高二上學期期末考試(理)化學試卷(解析版) 題型:選擇題
下列過程需要吸收熱量的是
A. 汽油燃燒 B. 鋁熱反應 C. 液氨汽化 D. 酸堿中和
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三適應性月考(五)理綜化學試卷(解析版) 題型:選擇題
下列說法正確的是
A. 丙烯分子中所有原子有可能在同一平面上
B. 乙醇、乙酸和苯可用溴水區分
C. 分子式為C4H8O2并能與乙醇發生酯化反應生成的有機物有2種
D. 苯的硝化反應、乙醇和氧氣制乙醛屬于同一類反應類型
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三3月高考適應性測試理綜化學試卷(解析版) 題型:簡答題
PFS是水處理中重要的絮凝劑,下圖是以回收的廢鐵屑為原料制備PFS的一種工藝流程。
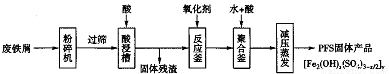
(1)酸浸槽以及聚合釜中用到的酸應是__________;PFS中鐵元素的化合價為__________;在酸浸槽中,為了提高浸出率,可以采取的措施有_________(寫兩條)。
(2)若廢鐵屬含有較多鐵銹(Fe2O3·xH2O),則酸浸時反應的化學方程式有_____________。
(3)如果反應釜中用H2O2作氧化劑,則反應的離子方程式為________;生產過程中,發現反應釜中產生了大量的氣體,且溫度明顯升高,其原因可能是___________。
(4)聚合釜中溶液的pH必須控制在一定的范圍內。如果溶液酸性過強,造成的后果是________。如果溶液酸性太弱又會生成大量的氫氧化鐵沉淀。若溶液中Fe3+的濃度為1mol·L-1,當Fe3+開始沉淀時,涪液的pH約為_________。[已知Fe(OH)3的Ksp≈1.0×10-39]。
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三第二次質檢化學試卷(解析版) 題型:選擇題
在某恒溫密閉容器中,投入一定量的A發生可逆反應:A(s) B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段時間后反應達到平衡,然后縮小容器體積,重新達到平衡。下列分析不正確的是
B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段時間后反應達到平衡,然后縮小容器體積,重新達到平衡。下列分析不正確的是
A. 兩次平衡時,C(g)的濃度相等
B. 平衡時,單位時間內n(B)生成:n(C)消耗=1:1
C. 若再向平衡體系中加入少量A,平衡不移動
D. 若開始時向容器中加入1 mol B和1 mol C,則達到平衡時吸收QkJ熱量
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省七市(州)高三第一次聯合調考(3月聯考)理科綜合化學試卷(解析版) 題型:實驗題
已知硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O] (俗稱莫爾鹽)可溶于水,在100℃~110℃時分解。為探究其化學性質,甲、乙兩同學設計了如下實驗。
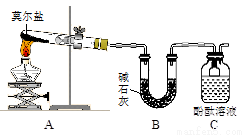
Ⅰ.探究莫爾鹽晶體加熱時的分解產物。
甲同學設計如右圖所示的裝置進行實驗,裝置C中可觀察到的現象是____________________,由此可知分解產物中有_______________。
乙同學認為莫爾鹽晶體分解的產物中還可能含有SO3(g)、SO2(g)及N2(g)。為驗證產物的存在,用下列裝置進行實驗。
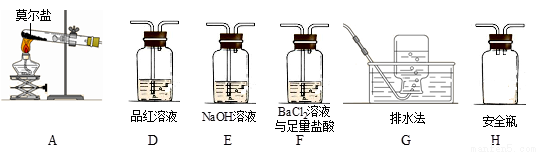
①乙同學的實驗中,裝置依次連接的合理順序為:A→H→(____)→(____)→(____)→G。
②證明含有SO3的實驗現象是______________;安全瓶H的作用是____。
Ⅱ.為測定硫酸亞鐵銨純度,稱取m g莫爾鹽樣品,配成500 mL溶液。甲、乙兩位同學設計了如下兩個實驗方案。甲方案:取25.00 mL樣品溶液用0.1000 mol·L-1的酸性K2Cr2O7 溶液分三次進行滴定。乙方案:(通過NH4+測定)實驗設計裝置如下圖所示。取25.00 mL樣品溶液進行該實驗。
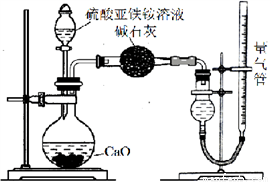
請回答:
(1)甲方案中的離子方程式為:________________________。
(2)乙方案中量氣管中最佳試劑是________
a.水 b.飽和NaHCO3溶液 c.CCl4
(3)乙方案中收集完氣體并恢復至室溫,讀數前應進行的操作是________________。
(4)若測得NH3為V L(已折算為標準狀況下),則硫酸亞鐵銨純度為_____(列出計算式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com