
根據元素周期律填空:
(1)已知SiH4能夠在空氣中自燃,H2S可燃,試推測PH3應 ;
(2)已知H2SiO3為弱酸,H2SO4為強酸,則H3PO4為 ;
(3)已知氫氧化鋁又稱為鋁酸(H3AlO3),當其失去水后變成HAlO2稱為偏鋁酸,則H3PO4稱為 ,而HPO3稱為 。
(4)已知NaOH為強堿,Al(OH)3為兩性氫氧化物,則Mg(OH)2為 。
科目:高中化學 來源: 題型:
(10分)填空回答:
(1)氮化硅是一種高溫陶瓷材料。根據元素周期律知識,寫出氮化硅的化學式: 。
(2)有A、B、C、D、E、F六種元素,它們均屬短周期元素,其原子序數依次增大,它們兩兩形成的化合物有以下幾種:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子個數比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
已知A、B兩元素的核電荷數之差等于其原子最外層電子數之和;B原子最外層電子數比次外層電子數多3個;C原子的最外層電子數是次外層電子數的3倍;D、E、F同周期,D、A同主族;E與F的原子序數之和為30,丙是離子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子結構示意圖為 ,乙的電子式為 ,丙的電子式為 ,B的最高價氧化物的水化物的化學式為 。
③向甲的水溶液中加入,反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省集賢縣第一中學高二上學期期末考試化學試卷(帶解析) 題型:填空題
(7分)填空回答:
(1)氮化硅是一種高溫陶瓷材料。根據元素周期律知識,寫出氮化硅的化學式: 。
(2)有A、B、C、D、E、F六種元素,它們均屬短周期元素,其原子序數依次增大,它們兩兩形成的化合物有以下幾種:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子個數比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
查看答案和解析>>
科目:高中化學 來源:2010年山東省高一第二學期期末考試化學試題 題型:填空題
(10分)填空回答:
(1)氮化硅是一種高溫陶瓷材料。根據元素周期律知識,寫出氮化硅的化學式: 。
(2)有A、B、C、D、E、F六種元素,它們均屬短周期元素,其原子序數依次增大,它們兩兩形成的化合物有以下幾種:
|
形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
化合物中各元素的原子個數比 |
A:C=1:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B兩元素的核電荷數之差等于其原子最外層電子數之和;B原子最外層電子數比次外層電子數多3個;C原子的最外層電子數是次外層電子數的3倍;D、E、F同周期,D、A同主族;E與F的原子序數之和為30,丙是離子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子結構示意圖為 ,乙的電子式為 ,丙的電子式為 ,B的最高價氧化物的水化物的化學式為 。
③向甲的水溶液中加入 ,反應的化學方程式為
。
,反應的化學方程式為
。
查看答案和解析>>
科目:高中化學 來源:09-10年東莞市高一下學期期末考試化學卷 題型:填空題
(15分)元素在周期表中的位置,反映了元素的原子結構和元素的性質。下圖是元素周期表的一部分。請用元素符號或化學式填空:
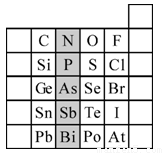
(1)所示元素中
①非金屬性最強的元素是:
②金屬性最強的元素是:
③原子半徑最小的是:
④最高價含氧酸酸性最強的是
⑤經常用作半導體材料的元素是: (只寫一種)
⑥陰影部分屬于元素周期表中的 族,該族元素的最高正價均為
(2)根據元素周期律,推導:
①酸性強弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②穩定性:H2S HCl
③沸點:HF HCl
④還原性:I- Br-
⑤在O、F、S、Cl四種元素中,非金屬性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根據同主族元素性質的相似性和遞變性進行預測:
①關于Se的預測正確的是:
A. 常溫下Se單質是氣體
B. Se最高價氧化物的水化物能和NaOH發生反應
C. 氫化物的化學式為H2Se
D. 常見的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反應,Cl2+2H2O+SO2==H2SO4+2HCl,寫出Br2在水溶液中和SO2反應的離子反應方程式___________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com