
【題目】金剛烷是一種重要的化工原料,工業上可通過下列途徑制備:

請回答下列問題:
(1)環戊二烯分子中最多有__________個原子共面;
(2)金剛烷的分子式為____________________,其分子中的CH2基團有__________個;
(3)下面是以環戊烷為原料制備環戊二烯的合成路線:
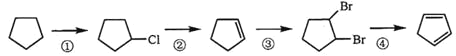
其中,反應①的產物名稱是_____________,反應②的反應試劑和反應條件是_________,反應③的反應類型是_____________;
(4)已知烯烴能發生如下的反應:  ,請寫出下列反應產物的結構簡式:
,請寫出下列反應產物的結構簡式: ___________。
___________。
(5)A是二聚環戊二烯的同分異構體,能使溴的四氯化碳溶液褪色,A經高錳酸鉀酸性溶液加熱氧化可以得到對苯二甲酸[提示:苯環的烷基(—CH3,—CH2R,—CHR2)或烯基側鏈經酸性高錳酸鉀溶液氧化得羧基],寫出A的一種結構簡式(不考慮立體異構):________________________。
【答案】9 C10H16 6 氯代環戊烷 氫氧化鈉乙醇溶液,加熱 加成反應 ![]()
![]() 、
、![]() 、
、![]() 、
、![]()
(![]() 不作要求)
不作要求)
【解析】
(1)由碳碳雙鍵為平面結構分析環戊二烯分子中最多共平面的原子數;
(2)金剛烷的分子中有6個CH2,4個CH結構,據此判斷其分子式;
(3)反應①的產物為氯代環戊烷,反應②為氯代烴的消去反應,反應③中碳碳雙鍵轉化為碳碳單鍵;
(4)由信息可知,碳碳雙鍵的碳被氧化為醛基;
(5)能使溴的四氯化碳溶液褪色,應含有碳碳雙鍵,A經高錳酸鉀酸性溶液加熱氧化可以得到對苯二甲酸,說明烴基位于苯環對位位置,據此分析書寫。
(1)C=C為平面結構,與雙鍵碳直接相連的原子一定在同一平面內,則5個C和4個H共9個原子在同一平面內,故答案為:9;
(2)由結構簡式可知金剛烷的分子式為C10H16,分子中有6個CH2,故答案為:C10H16;6;
(3)反應①的產物為氯代環戊烷,反應②為氯代烴的消去反應,應在氫氧化鈉乙醇溶液,加熱條件下反應生成,反應③中碳碳雙鍵轉化為碳碳單鍵,屬于加成反應,故答案為:氯代環戊烷;氫氧化鈉乙醇溶液,加熱;加成反應;
(4)由信息可知,碳碳雙鍵的碳上含H原子被氧化為醛,則發生:![]()
![]()
![]()
![]() ,故答案為:
,故答案為:![]() ;
;
(5)A是二聚環戊二烯(![]() )的同分異構體,能使溴的四氯化碳溶液褪色,應含有碳碳雙鍵,A經高錳酸鉀酸性溶液加熱氧化可以得到對苯二甲酸,說明烴基位于苯環對位位置,可能的結構有
)的同分異構體,能使溴的四氯化碳溶液褪色,應含有碳碳雙鍵,A經高錳酸鉀酸性溶液加熱氧化可以得到對苯二甲酸,說明烴基位于苯環對位位置,可能的結構有![]() 、
、![]() 、
、![]() 、
、![]() ,故答案為:
,故答案為:![]() 、
、![]() 、
、![]() 、
、![]() 。
。


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】某學生想利用下圖裝置(燒瓶位置不能移動)收集下列氣體:
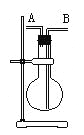
① H2②Cl2③CH4④HCl ⑤NH3⑥NO ⑦NO2⑧SO2,
下列操作正確的是
A. 燒瓶是干燥的,由A進氣收集①③⑤
B. 燒瓶是干燥的,由B進氣收集②④⑥⑦⑧
C. 在燒瓶中充滿水,由A進氣收集①③⑤⑦
D. 在燒瓶中充滿水,由B進氣收集⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表中的W、X、Y、Z均為短周期元素,其原子最外層電子數之和為22。下列說法不正確的是( )
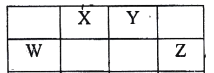
A.以上元素都可以與H元素形成18電子的分子
B.X的氧化物都不是酸性氧化物
C.Y與金屬鈉形成的化合物可能含有非極性共價鍵
D.1mol W的單質與足量的Z的單質反應,轉移電子數為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298 K、101kPa時,N2與H2反應過程中能量變化的曲線圖,下列敘述錯誤的是( )
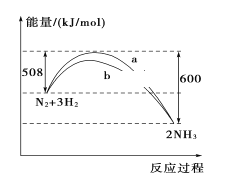
A. 加入催化劑,不能改變該化學反應的反應熱
B. b曲線是加入催化劑時的能量變化曲線
C. 該反應的熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常溫、體積一定的條件下,通入1 mol N2和3 mol H2,反應后放出的熱量為92 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產鈉和燒堿的原理如下:①電解熔融氯化鈉制鈉:2NaCl(熔融) ![]() 2Na+Cl2↑,②電解飽和食鹽水制燒堿:2NaCl+2H2O
2Na+Cl2↑,②電解飽和食鹽水制燒堿:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,下列有關說法正確的是( )
2NaOH+H2↑+Cl2↑,下列有關說法正確的是( )
A.在反應①和②中,氯化鈉均既是氧化劑,又是還原劑
B.在反應①中氯氣是還原產物,在反應②中氫氣是還原產物
C.若標準狀況下生成等體積的氣體,則反應①和②中轉移電子總數相等
D.若消耗等質量的氯化鈉,則反應①和②中轉移電子總數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子序數依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y兩種元素的核電荷數之差等于它們的原子最外層電子數之和;Y、Z位于相鄰主族;Z是地殼中含量最高的元素;X、W是同主族元素。上述五種元素兩兩間能形成四種常見的化合物甲、乙、丙、丁,這四種化合物中原子個數比如下表:
甲 | 乙 | 丙 | 丁 | |
化合物中各元素原子個數比 |
|
|
|
|
(1)寫出下列元素符號:Y_____________,Z_______________,W_____________,R________________。
(2)寫出下列化合物的電子式:乙_______________,丙__________________。
(3)向甲的水溶液中加入丁,有淡黃色沉淀生成,請寫出反應的化學方程式:__________________。
(4)甲和乙反應能放出大量的熱,同時生成兩種無污染的物質,請寫出該反應的化學方程式:______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下如圖所示,是原電池的裝置圖。請回答:
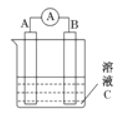
(1)若C為稀H2SO4溶液,電流表指針發生偏轉,B電極材料為Fe,A極材料為銅,A為______極,A電極上發生的電極反應式為___________________________,反應進行一段時間后溶液C的c(H+)將___________(填“變大”“減小”或“基本不變”)。
(2)若C為CuSO4溶液,B電極材料為Zn,A極材料為銅。則B為_________極,B極發生________反應(填“氧化或還原),B電極上發生的電極反應為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示實驗裝置進行相應實驗,能達到實驗目的的是( )
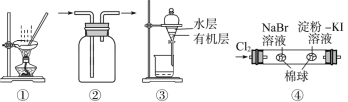
A. 用圖①所示裝置,蒸干NH4Cl飽和溶液制備NH4Cl晶體
B. 按裝置②所示的氣流方向可用于收集H2、NH3等
C. 用圖③所示裝置,分離CCl4萃取I2水后的有機層和水層
D. 用圖④所示裝置,可以證明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)為了驗證 Fe2+與 Cu2+氧化性強弱,下列裝置能達到實驗目的的是_______(填裝置序號), 其正極的電極反應式為_______;若構建該原電池時兩個電極的質量相等,當導線中通過 0.4 mol 電子時,兩個電極的質量差為_______g。
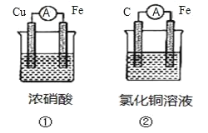
(2)將 CH4 設計成燃料電池,其利用率更高,裝置如圖所示(A、B 為多孔碳棒)。

實驗測得 OH- 定向移向 A 電極,則_______(填 A 或 B)處電極入口通 CH4,其電極反應式為_______。
(3)金屬冶煉和處理常涉及氧化還原反應。由下列物質冶煉相應金屬時采用電解法的是_______(填選 項字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com