
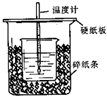
 已知稀的酸與稀的堿發生中和反應,生成1mol水所放出的熱叫中和熱,用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
已知稀的酸與稀的堿發生中和反應,生成1mol水所放出的熱叫中和熱,用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:| 實驗次數 | 酸的溫度 | 堿的溫度 | 反應最高溫度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
分析 (1)根據量熱計的構造來判斷該裝置的缺少儀器;
(2)反應放出的熱量和所用酸以及堿的量的多少有關,并根據中和熱的概念和實質來回答;
(3)先根據表中測定數據計算出混合液反應前后的平均溫度差,再根據Q=m•c•△T計算出反應放出的熱量,然后計算出生成1mol水放出的熱量,就可以得到中和熱;
(4)根據弱電解質電離吸熱分析.
解答 解:(1)根據量熱計的構造可知該裝置的缺少儀器是環形玻璃攪拌器,故答案為:環形玻璃攪拌器;
(2)反應放出的熱量和所用酸以及堿的量的多少有關,如果用60mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液進行反應,與上述實驗相比,生成水的量增多,所放出的熱量偏高,但是中和熱的均是強酸和強堿反應生成1mol水時放出的熱,與酸堿的用量無關,所以用60mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液進行上述實驗,測得中和熱數值相等;
故答案為:不相等;相等;
(3)第1次實驗鹽酸和NaOH溶液起始平均溫度為21℃,反應后溫度為:24.3℃,溫度差為:3.3℃;
第2次實驗鹽酸和NaOH溶液起始平均溫度為21.5℃,反應后溫度為:25.0℃,溫度差為:3.5℃;
第3次實驗鹽酸和NaOH溶液起始平均溫度為17.25℃,反應后溫度為:21.5℃,溫度差為:4.25℃;
第3組誤差較大,舍去,其他三兩次溫度差平均值為3.4℃;
用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液,生成水的物質的量為0.05L×0.50mol/L=0.025mol,溶液的質量為100mL×1g/ml=100g,則生成0.025mol水放出的熱量為Q=m•c•△T=100g×4.17J/(g•℃)×3.4℃=1417.8J,即1.4178KJ,所以實驗測得的中和熱△H=-$\frac{1.4178KJ}{0.025mol}$=-56.8kJ/mol;
故答案為:-56.8kJ/mol;
(4)一水合氨為弱堿,電離過程為吸熱過程,用相同濃度和體積的氨水(NH3•H2O)代替NaOH溶液進行上述實驗,測得的中和熱的數值偏小;
故答案為:偏小.
點評 本題主要考查熱中和熱概念、測定原理及反應熱的計算,題目難度中等,注意理解中和熱的概念以及測定反應熱的誤差等問題.


科目:高中化學 來源: 題型:選擇題
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反應:C(金剛石,s)═C(石墨,s)△H<0,C(金剛石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
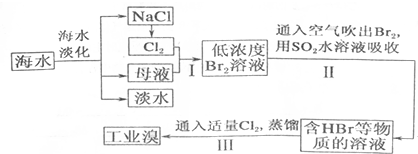
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向洗滌液中滴加氯化鈣溶液可檢驗沉淀是否洗滌干凈 | |
| B. | 上述變化過程中包括了分解、化合、復分解、置換等四種反應類型 | |
| C. | 步驟④在氯化氫熱氣流中加熱晶體的目的是為了防止氯化鎂水解 | |
| D. | 步驟⑤也可以采用電解該鹽水溶液的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3molNO2、0.1molNO | B. | 0.6molNO | ||
| C. | 0.3molNO、0.1molNO2 | D. | 0.2molNO2、0.2molNO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.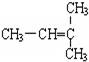 和
和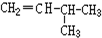
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 ,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式為CN-+H2O2+H2O═NH3↑+HCO3-.
,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式為CN-+H2O2+H2O═NH3↑+HCO3-.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com