
| A. | 0.1mol/LFeCl3溶液中,Fe3+的物質的量一定小于0.1NA | |
| B. | 6.6gCO2分子中含的共用電子對數為0.6NA | |
| C. | 標準狀況下,22.4LNO和11.2L02混合后氣體的分子總數為NA | |
| D. | 6.4g銅與足量的硫充分反應,則轉移的電子教為0.2N |
分析 A.缺少溶液體積,無法計算鐵離子的物質的量;
B.二氧化碳分子中含有4對共用電子對,根據n=$\frac{m}{M}$計算出二氧化碳的物質的量,再計算出含有電子數;
C.二氧化氮與四氧化二氮中存在轉化平衡,導致反應后氣體總分子數減少;
D.銅與S反應生成的是氯化亞銅,6.4g銅的物質的量為0.1mol,完全反應后失去0.1mol電子.
解答 解:A.沒有告訴0.1mol/LFeCl3溶液的體積,無法計算溶液中含有鐵離子的數目,故A錯誤;
B.6.6g二氧化碳的物質的量為:$\frac{6.6g}{44g/mol}$=0.15mol,二氧化碳的電子式為 ,則0.15mol二氧化碳分子中含有共用電子對的物質的量為:0.15mol×4=0.6mol,含有的共用電子對數為0.6NA,故B正確;
,則0.15mol二氧化碳分子中含有共用電子對的物質的量為:0.15mol×4=0.6mol,含有的共用電子對數為0.6NA,故B正確;
C.標準狀況下,22.4LNO的物質的量為:$\frac{22.4L}{22.4L/mol}$=1mol,11.2L氧氣的物質的量為:$\frac{11.2L}{22.4L/mol}$=0.5mol,二者恰好反應生成1mol二氧化氮,由于部分二氧化氮轉化成四氧化二氮,導致反應后氣體分子數減少,所以混合后氣體的分子總數小于NA,故C錯誤;
D.6.4g銅的物質的量為:$\frac{6.4g}{64g/mol}$=0.1mol,0.1mol銅與硫反應生成0.05mol氯化亞銅,轉移了0.1mol電子,轉移的電子教為0.2NA,故D錯誤;
故選B.
點評 本題考查了阿伏伽德羅常數的綜合應用,題目難度中等,明確物質的量與阿伏伽德羅常數、摩爾質量之間的關系為解答關鍵,試題培養了學生的分析能力及化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L H2中所含質子數、中子數均為2NA | |
| B. | 46g NO2氣體和46g N2O4氣體的分子數之比為2:1 | |
| C. | 1L 1 mol•L-1的鹽酸中所含粒子總數為2NA | |
| D. | 71g氯氣與足量鐵粉充分反應,轉移的電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向濃度為0.1 mol/L 的FeCl3和CuCl2混合溶液加入鐵粉,CuCl2首先反應 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反應 | |
| C. | 向濃度均為0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2氣體,NaOH先反應 | |
| D. | 向濃度均為0.1 mol/L的FeBr2通入少量氯氣,Br-首先反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )
在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )| A. | 鹽酸中逐滴加入食鹽溶液 | B. | 醋酸中逐滴加入氫氧化鈉溶液 | ||
| C. | 氫氧化鋇溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | C-H | C-C | C═C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | 612 | 436 |
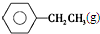 $\stackrel{催化劑}{?}$
$\stackrel{催化劑}{?}$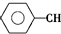 ≡CH2(g)+H2(g)的反應熱△H為( )
≡CH2(g)+H2(g)的反應熱△H為( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Fe2+、NO3- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com