
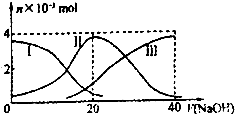
 常溫下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有關微粒的物質的量 變化如圖(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根據圖示判斷,下列說法正確的是( )
常溫下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有關微粒的物質的量 變化如圖(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根據圖示判斷,下列說法正確的是( )| A、當V(NaOH)=20mL時,溶液中離子濃度大小關系 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等體積等濃度的NaOH溶液與H2A溶液混合后其溶液中水的電離程度比純水大 |
| C、欲使NaHA溶液呈中性,可以向其中加入酸或堿 |
| D、向NaHA溶液加人水的過程中,pH可能增大也可能減小 |


科目:高中化學 來源: 題型:
| A、非金屬元素(稀有氣體元素除外)都是主族元素,單質在反應中都只能作氧化劑 |
| B、常溫下,1mol氯氣和足量稀NaOH溶液完全反應轉移1mol電子 |
| C、在加熱條件下,用乙醇除去乙酸乙酯中的乙酸 |
| D、硫酸銅溶液顯酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、一個16O原子的質量為16 g | ||
| B、氧元素的近似相對原子質量為(16a%+17b%+18c%) | ||
C、氧元素的近似相對原子質量為:
| ||
| D、氧元素的相對原子質量為(16a%+17b%+18c%) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、單位時間內生成n mol A2的同時消耗n mol B2 |
| B、容器內,AB、A2、B2三種氣體共存 |
| C、AB的消耗速率等于A2的消耗速率 |
| D、容器中各組分的體積分數不隨時間變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、1:2 | B、2:1 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 物質 | 所含雜質 | 除去雜質的方法 | |
| A | CO | CO2 | 通過足量氫氧化鈉溶液,干燥 |
| B | NaCl | 泥沙 | 溶解、過濾、蒸發 |
| C | NaOH溶液 | Na2CO3 | 加入足量稀鹽酸至不再產生氣泡 |
| D | Cu(NO3)2溶液 | AgNO3 | 加入過量的銅粉,過濾 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化學 來源: 題型:
 已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.
已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、c(HCO3-)<c(CO32-) |
| B、c(HCO3-)>c(HSO3-) |
| C、c(CO32-)+c(HCO3-)═c(SO32-)+c(HSO3-) |
| D、兩溶液都能使酸性高錳酸鉀溶液褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com