
【題目】下表為元素周期表的一部分, 回答下列問題。
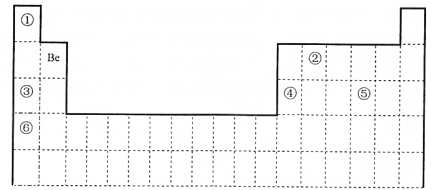
(1)我國科學家采用“鋁鈹測年法”測量“北京人”年齡。10Be 和9Be______________
a.是同一種核素 b.具有相同的中子數 c.互為同素異形體 d.互為同位素
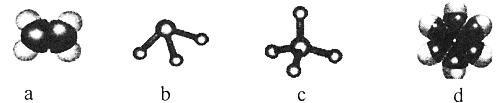
(2)元素①和②可形成多種化合物。下列模型表示的分子中,不可能由①和②形成的是_______(填序號)。
(3)元素①~⑥中,金屬性最強的是___(填元素符號)。②的單質和⑤的最高價氧化物對應水化物的濃溶液反應的化學方程式為______________。
(4)碘(53I) 是人體必需的微量元素之一。
①碘(53I) 在周期表中的位置是______
②CI-、Br-、I-的還原性由大到小的順序為_______。
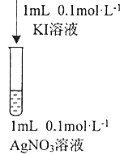
③資料顯示: Ag+和I-會發生氧化還原反應生成兩種單質,反應的離子方程式為_______。某同學用圖實驗驗證上述反應,觀察到兩溶液混合后立即出現黃色渾濁,再加入淀粉溶液,不變藍。分析產生上述現象的可能原因:________________
【答案】d b K
C+2H2SO4(濃)![]() CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-發生氧化還原反應的速率慢于發生沉淀反應的速率。物質的氧化性、還原性受濃度或溫度影響,溶液中離子濃度較小或溫度不夠,氧化還原反應不易發生
CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-發生氧化還原反應的速率慢于發生沉淀反應的速率。物質的氧化性、還原性受濃度或溫度影響,溶液中離子濃度較小或溫度不夠,氧化還原反應不易發生
【解析】
質子數相同,中子數不同的一類原子互稱為同位素;根據元素在周期表中的位置可知,①為H元素,②為C元素,③為Na元素,④為Al元素,⑤為S元素,⑥為K元素。
(1) 10Be和9Be的質子數相同,但中子數不同,故兩者互為同位素。
(2)元素①為H和②為C,兩者形成分子時,C原子能形成4條共價鍵,H原子形成1條共價鍵。a為乙烯,c為甲烷,d為苯,均由C、H組成; 但c分子的中心原子形成3條鍵,不符合碳的四價鍵原子,故不是由C、H元素形成的。
(3)同周期從左到右,同主族從上到下,元素金屬性越來越強,故元素①~⑥中,金屬性最強的是K。②的單質為C,⑤的最高價氧化物對應水化物的濃溶液為濃硫酸,碳與濃硫酸反應生成二氧化硫、二氧化碳和水,反應的化學方程式為C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(4)①碘(53I)在周期表中的位置是第五周期ⅦA (或第5周期ⅦA)。
②同主族從上到下,相應陰離子的還原性越來越強,故CI-、Br-、I-的還原性由大到小的順序為I->Br->Cl-。
③Ag+和I-會發生氧化還原反應生成兩種單質,這兩種單質為銀和碘,故反應的離子方程式為2Ag++2I-=2Ag↓+I2;碘化鉀溶液和硝酸銀溶液混合后立即出現黃色渾濁,再加入淀粉溶液,不變藍,則銀離子與碘離子反應生成碘化銀,原因可能為Ag+和I-發生氧化還原反應的速率慢于發生沉淀反應的速率;物質的氧化性、還原性受濃度或溫度影響,溶液中離子濃度較小或溫度不夠,氧化還原反應不易發生。


科目:高中化學 來源: 題型:
【題目】標況下把V體積氨氣溶于1體積水中得到氨的飽和溶液,試完成下列填空。
(1)NH3通入水中發生的反應為____________________。
(2)氨水中存在的分子有__________________________。
(3)氨水中存在的離子有__________________________。
(4)所得氨水的質量分數為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“碳呼吸”電池原理如圖所示,(電解質溶液為含C2O![]() 的鹽溶液,電池總反應為2A1+ 6CO2=Al2(C2O4)3,下列有關說法正確的是
的鹽溶液,電池總反應為2A1+ 6CO2=Al2(C2O4)3,下列有關說法正確的是

A.Al作負極B.C2O![]() 由負極遷移至正極
由負極遷移至正極
C.該裝置將電能轉變為化學能D.每生成1 mol Al2(C2O4)3,需要消耗134.4L的CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗裝置圖回答(裝置用代號表示)

①實驗室制用高錳酸鉀制氧氣時,應選用的發生裝置是_____;制氫氣時應選用的發生裝置是_____,制二氧化碳時應選用的發生裝置是_____,檢驗二氧化碳氣體可選用D裝置,其裝置中盛放的試劑一般是_______。
②用鋅粒和濃鹽酸反應制氫氣,將制成的氣體通入硝酸銀,有白色沉淀,說明氫氣中含有(寫化學式)_____,反應方程式為______,若要制出純凈的氫氣,除發生裝置外還應選用的一種裝置是_____;該裝置中藥品的作用是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W 是四種原子序數依次增大的短周期元素,W 的最外層電子數比 X 的最外層電子數少1個,X、Y、Z為同一周期元素,X、Y、Z組成一種化合物(ZXY)2 的結構式如圖所示。下列說法錯誤的是
![]()
A.化合物 WY 是良好的耐熱沖擊材料
B.Y的氧化物對應的水化物可能是弱酸
C.Y的簡單氫化物的沸點一定高于 Z
D.化合物(ZXY)2 中所有原子均滿足 8 電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁、鐵在生活、生產中有著廣泛的用途,請回答下列問題。
(1) Fe2+的最外層電子排布式____________。元素Fe與Mn的第三電離能分別為I3(Fe)、I3(Mn),則I3(Fe)______I3(Mn)(填“>”、“<")。
(2)氣態氯化鋁的分子組成為(AlCl3)2,其中Al、Cl均達8e-穩定結構,Al原子的雜化方式為__________。根據等電子原理,AlO2-的空間構型為_____。
(3) Fe(CO)5的熔點為-20 ℃,沸點為103 ℃,易溶于乙醚,其晶體類型為______,
(4) 科學家們發現某些含鐵的物質可催化尿素合成肼(N2H4),沸點:N2H4>C2H6的主要原因為______________________。
(5) FeO晶體的晶胞如圖所示,己知:FeO晶體的密度為ρ g/cm3,NA代表阿伏加德羅常數的值。在該晶胞中,與Fe2+緊鄰且等距離的Fe2+數目為_____;Fe2+與O2-最短核間距為______pm(用ρ和NA表示)。
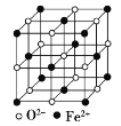
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵、碳等元素的單質及其化合物在化工醫藥、材料等領域有著廣泛的應用.回答下列問題:
(1)![]() 的名稱是三硝酸六尿素合鐵
的名稱是三硝酸六尿素合鐵![]() Ⅲ
Ⅲ![]() ,是一種重要的配合物.該化合物中
,是一種重要的配合物.該化合物中![]() 的核外電子排布式為____,所含非金屬元素的電負性由大到小的順序為___
的核外電子排布式為____,所含非金屬元素的電負性由大到小的順序為___![]() 碳原子為____雜化,
碳原子為____雜化,![]() 的空間構型為_____.
的空間構型為_____.
(2)尿素分子中![]() 鍵
鍵![]() 鍵的數目之比_____.
鍵的數目之比_____.
(3)目前發現的鋁原子簇![]() 的性質與鹵素相似,則原子簇
的性質與鹵素相似,則原子簇![]() 屬于____晶體.
屬于____晶體.![]() 存在的化學鍵有_____
存在的化學鍵有_____![]() 填字母
填字母![]() .
.
A.離子鍵 ![]() 極性鍵
極性鍵 ![]() 非極性鍵
非極性鍵 ![]() 配位鍵
配位鍵 ![]() 氫鍵
氫鍵 ![]() 金屬鍵
金屬鍵
(4)已知: ,反應后,
,反應后,![]() 鍵_____,
鍵_____,![]() 鍵_____
鍵_____![]() 填“增加”或“減少”
填“增加”或“減少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域![]() 鍵”,如
鍵”,如![]() 分子中存在“離域
分子中存在“離域![]() 鍵”,可表示成
鍵”,可表示成![]() ,則
,則![]()
![]() 咪唑
咪唑![]() 中的“離域
中的“離域![]() 鍵”可表示為_________
鍵”可表示為_________
(6)奧氏體是碳溶解在![]() 中形成的一種間隙固溶體,晶胞為面心立方結構,如圖所示.若晶體密度為
中形成的一種間隙固溶體,晶胞為面心立方結構,如圖所示.若晶體密度為![]() ,則晶胞中最近的兩個碳原子之間的距離為______
,則晶胞中最近的兩個碳原子之間的距離為______![]() 阿伏加德羅常數的值用
阿伏加德羅常數的值用![]() 表示,寫出簡化后的計算式即可
表示,寫出簡化后的計算式即可![]() .
.

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數。下列說法正確的是( )
①在標準狀況下,NA個SO3分子所占的體積為22.4L
②S2和S8的混合物共6.4g,其中所含硫原子數一定為0.2NA
③標準狀祝下,22.4LNO和11.2LO2混合后氣體的分子總數為1.5 NA
④1molAlCl3溶于1L的水中,所得溶液含有1NAAl3+
⑤在標準狀況下,22.4LCl2與足量的氫氧化鉀溶液反應轉移的電子數為NA
⑥100mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-離子數的總和是0.5NA
A.②⑤ B.①②④⑥ C.③⑤⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將質量為mg的銅屑完全溶于適量濃硝酸中,反應后得到NO2、NO的混合氣體,將所得氣體通入300mL2molL-1NaOH溶液中,恰好完全反應,生成含NaNO3和NaNO2的鹽溶液,其中NaNO3的物質的量為0.2mol,則m的值為( )
A.12.8B.19.2C.25.6D.51.2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com