
【題目】某溫度下,物質X2SO4的飽和溶液密度為ρg·mL-1,c(X+)=cmol·L-1 ,溶質 的質量分數為a% ,溶質的摩爾質量為Mg·mol-1,溶解度為Sg,下列表達式正確的是( )
A. c=2000ρa/M B. a%=c/2000ρ
C. M=1000ρa%/c D. S=100cM/(2000ρ-cM)
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列反應中生成物的總能量高于反應物的總能量的是
A. Zn與稀硫酸反應放出氫氣 B. 醋酸和氫氧化鈉的中和反應
C. 硫在空氣中燃燒 D. Ba(OH)2·8H2O與NH4Cl反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用膽礬制取氧化銅,并研究氧化銅能否在氯酸鉀受熱分解實驗中起催化作用,實驗步驟如下:①稱量ag膽礬固體放入燒杯中,加水制成溶液,向其中滴加氫氧化鈉溶液至沉淀完全;②過濾步驟①中的混合物,洗滌固體;③將②中的固體轉移至蒸發皿中,加熱至固體全部變成黑色氧化銅為止,稱量所得固體質量為bg;④取一定質量的上述氧化銅固體和一定質量的氯酸鉀固體,混合均勻后加熱,收集反應生成的氧氣(裝置如圖所示)。請回答下列問題:
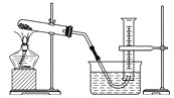
(1)上述各步操作中,需要用到玻璃棒的是________(填寫前面所述實驗步驟的序號)。
(2)由膽礬制得的氧化銅的產率(實際產量與理論產量的百分比)為________×100%。
(3)為證明氧化銅在氯酸鉀的分解反應中起催化作用,在上述實驗①~④后還應該進行的實驗操作是__________(按實驗先后順序填寫字母序號)。
a.過濾 b.烘干 c.溶解 d.洗滌 e.稱量
(4)但有很大一部分同學認為,還必須另外再設計一個實驗才能證明氧化銅在氯酸鉀受熱分解的實驗中起催化作用。你認為還應該進行的另一個實驗是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某氟化稀土樣品中氟元素的質量分數,某化學興趣小組進行如下了實驗。
利用高氯酸(高沸點酸)將樣品中的氟元素轉化為氟化氫(低沸點酸)蒸出,再通過滴定測量。
實驗裝置如圖所示。

(1)a的作用是____________,儀器d的名稱是________________ 。
(2)檢查裝置氣密性:____________(填操作),關閉k,微熱c,導管e末端有氣泡冒出;停止加熱,導管e內有一段穩定的水柱,說明裝置氣密性良好。
(3)c中加入一定體積高氯酸和mg氟化稀土樣品,Z中盛有滴加酚酞的NaOH溶液。加熱b、c,使b中產生的水蒸氣進入c。
①下列物質可代替高氯酸的是_________(填序號)。
A.硝酸 B.鹽酸 C.硫酸 D.磷酸
②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成。若有SiF4生成,實驗結果將__________(填“偏高”“ 偏低”或“不受影響”)。
③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結果偏低,原因是______________。
(4)向餾出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA標準溶液滴定剩余La3+(La3+與EDTA按1:1絡合),消耗EDTA標準溶液V2ml,則氟化稀土樣品中氟的質量分數為______________。
(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應溫度、蒸餾時間),測量并計算出氟元素質量,重復多次。該操作的目的是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在體積為V L的密閉容器中發生化學反應CO(g)+2H2(g)![]() CH3OH(g),可判斷該可逆反應達到化學平衡狀態的標志是
CH3OH(g),可判斷該可逆反應達到化學平衡狀態的標志是
A. v生成(CH3OH)=v消耗(CO)
B. 混合氣體的密度不再改變
C. 混合氣體的平均相對分子質量不再改變
D. CO、H2、CH3OH的濃度比為1:2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中甲為甲烷和O2構成的燃料電池示意圖,電解質為KOH溶液,乙為電解飽和MgCl2溶液的裝置,其中乙裝置中X為陽離子交換膜。用該裝置進行實驗,反應開始后觀察到Fe電極附近出現白色沉淀。下列說法正確的是

A. 甲、乙中電解質溶液的pH都增大
B. 理論上甲中每消耗22.4 L CH4(標準狀況下),乙中產生4 mol Cl2
C. 乙中電解MgCl2溶液的總反應為2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 甲中A處通入CH4,電極反應式為CH4+10OH--8e- =![]() +7H2O
+7H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種可用于生物醫學領域的平面五角星形鈀(Ⅱ)配位絡離子結構如右圖,已知鈀是原子序數為46的過渡元素。
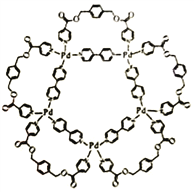
回答下列問題。
(1)鈀(Ⅱ)配位絡離子中的第二周期元素,其第一電離能從大到小的順序為_____________(填元素符號)。
(2)鈀(Ⅱ)配位絡離子中含有的作用力類型為___________ (填序號)。
A.金屬鍵 B.離子鍵 C.共價鍵 D.配位鍵 E.氫鍵 F.范德華力
(3)鈀(Ⅱ)配位絡離子中基態鈀離子價電子排布式為____________,鈀離子的雜化軌道類型_______(填“是”或“不是”)sp3,理由是___________。
(4)鈀(Ⅱ)配位絡離子中能與氫氧化鈉溶液反應的配體,其分子式為__________,每1mol該配體與氫氧化鈉反應時斷裂的共價鍵類型及數目為____________。
(5)鈀易與亞砜(![]() )生成配合物。當R1和R2都為-CH2C6H5時,三種配合物的結構和鍵長數據如下:
)生成配合物。當R1和R2都為-CH2C6H5時,三種配合物的結構和鍵長數據如下:
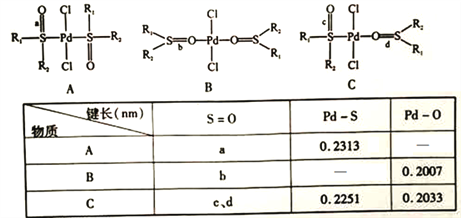
①亞砜的晶體類型為___________________。
②配位鍵穩定性:Pd-s>Pd-O,其證據為______________ (用上表數據說明)。
③三種配合物中S=O鍵長不同,其數值最小的是______________(填“a"“b"“c”或“d")
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于芳香族化合物的敘述正確的是()
A. 是苯和苯的同系物
B. 符合通式CnH2n-6(n≥6)的化合物
C. 是分子中含有苯環的烴
D. 是分子中含有苯環的有機物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com