
���}Ŀ����D��Na��Cu��Si��H��C��N��Ԫ�؆��|(zh��)�����c(di��n)�ߵ��������c��d���ǟ��늵�����(d��o)�w��
��1��Ո(q��ng)�����ψD��e���|(zh��)��(du��)��(y��ng)Ԫ��ԭ�ӵ�����Ų�ʽ��________��
��2��a��b��f��(du��)��(y��ng)��Ԫ����ԭ�ӂ�(g��)��(sh��)��1��1��1�γɵķ��������I�����I��(g��)��(sh��)֮�Ȟ�___��
��3���D��d���|(zh��)�ľ��w�ѷe��ʽ����ǣ�____��
��4��a�cbԪ���γɵ�10������Է���X�Ŀ��g��(g��u)�͞�_____����X����ˮ�����Һ���뺬dԪ�ظ߃r(ji��)�x�ӵ���Һ�����^�������ɵĺ�dԪ���x�ӵĻ��W(xu��)ʽ��___������X�cd�ĸ߃r(ji��)�x��֮�g��___�I�M�ϡ�
��5���������������NԪ���е�һ�NԪ���γɵĺ�����ĽY(ji��)��(g��u)��![]() ��Ո(q��ng)��(ji��n)Ҫ�f��ԓ���|(zh��)������ˮ��ԭ��_____________��
��Ո(q��ng)��(ji��n)Ҫ�f��ԓ���|(zh��)������ˮ��ԭ��_____________��
���𰸡�1s22s22p63s23p2��[Ne]3s23p2 1:1 �����������ܶѷe �����F�� [Cu(NH3)4]2�� ��λ HNO3�ǘO�Է��ӣ�������(�O�Ե�)ˮ�У�HNO3�����е�H��O���cˮ�����е�O��H֮�g�γɚ��I��
��������
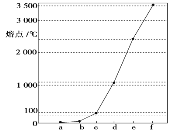
Na��Cu��Si��H��C��N��Ԫ�؆��|(zh��)�У�Na��Cu����پ��w�����ǟ��늵�����(d��o)�w��C��Si�Ć��|(zh��)��ԭ�Ӿ��w����C���|(zh��)���۷��c(di��n)����Siԭ�Ӿ��w���۷��c(di��n)��H��N��(du��)��(y��ng)�Ć��|(zh��)����Ӿ��w�����К������c(di��n)��ͣ��ɈD���c(di��n)�ĸߵ�����֪a��H��b��N��c��Na��d��Cu��e��Si��f��C���Y(ji��)�ό�(du��)��(y��ng)���|(zh��)��������ĽY(ji��)��(g��u)�����|(zh��)�Լ�Ԫ�������ɵ��f׃Ҏ(gu��)�ɽ��ԓ�}��
�ɷ�����֪��a��H��b��N��c��Na��d��Cu��e��Si��f��C��
��1��e��Si������|(zh��)��(du��)��(y��ng)Ԫ��ԭ�ӵ�����Ų�ʽ�飺1s22s22p63s23p2��[Ne]3s23p2���ʴ𰸞飺1s22s22p63s23p2��[Ne]3s23p2��
��2�����|(zh��)a��b��f��(du��)��(y��ng)��Ԫ����ԭ�ӂ�(g��)��(sh��)��1��1��1�γɵķ��Ӟ�HCN���Y(ji��)��(g��u)ʽ��H-C��N��������к���1��(g��)C-H���I��1��(g��)-C��N�I������1��(g��)���I��2��(g��)���I��������H-C��N�к���2��(g��)���I��2��(g��)���I�����I�����I��(g��)��(sh��)֮�Ȟ�1:1���ʴ𰸞飺1:1��
��3��Cu���|(zh��)�ľ��w�ѷe��ʽ����������������ܶѷe���ʴ𰸞飺�����������ܶѷe��
��4��a�cbԪ���γɵ�10������Է���X��NH3����������Ѓr(ji��)����ӌ�(du��)��(g��)��(sh��)��=3+![]() ����5-3��1��=4�����Ե�ԭ���s����ʽ��sp3����?y��n)麬��һ��(g��)����ӌ�(du��)��������Ŀ��g��(g��u)�͞������F�Σ���NH3����ˮ�����Һ���뵽��CuԪ�ظ߃r(ji��)�x�ӵ���Һ�����^����Cu2+�ṩ��܉������������ṩ��(du��)��ӣ��ṩ��λ�I�γ��İ����~�j(lu��)�x�ӣ��仯�W(xu��)ʽ�飺[Cu(NH3)4]2�����ʴ𰸞飺�����F�Σ�[Cu(NH3)4]2������λ��
����5-3��1��=4�����Ե�ԭ���s����ʽ��sp3����?y��n)麬��һ��(g��)����ӌ�(du��)��������Ŀ��g��(g��u)�͞������F�Σ���NH3����ˮ�����Һ���뵽��CuԪ�ظ߃r(ji��)�x�ӵ���Һ�����^����Cu2+�ṩ��܉������������ṩ��(du��)��ӣ��ṩ��λ�I�γ��İ����~�j(lu��)�x�ӣ��仯�W(xu��)ʽ�飺[Cu(NH3)4]2�����ʴ𰸞飺�����F�Σ�[Cu(NH3)4]2������λ��
��5������(j��)������ĽY(ji��)��(g��u)��֪ԓ���HNO3��HNO3�ǘO�Է��ӣ������ژO�Ե�ˮ�в���HNO3�����е�H��O���cˮ�����е�O��H֮�g�γɚ��I��������ˮ���ʴ𰸞飺HNO3�ǘO�Է��ӣ�������(�O�Ե�)ˮ�У�HNO3�����е�H��O���cˮ�����е�O��H֮�g�γɚ��I��



| �꼉(j��) | �����n�� | �꼉(j��) | �����n�� |
| ��һ | ��һ���M(f��i)�n�����]�� | ��һ | ��һ���M(f��i)�n�����]�� |
| �߶� | �߶����M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
| ���� | �������M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ����(sh��)�(y��n)�}��
1-�������һ�N��Ҫ���ЙC(j��)�ϳ����g�w�����c(di��n)��71�棬�ܶȞ�1.36g��cm-3����(sh��)�(y��n)���Ƃ����� 1-��������Ҫ���E���£�
���E 1���ڃx�� A �м��딇����ӡ�12g �������� 20mLˮ����ˮ��s�¾������� 28ml�� H2SO4����s���Ҝأ������¼��� 24gNaBr��
(��֪�� ��2NaBr+H2SO4(��)![]() Na2SO4+2HBr��
Na2SO4+2HBr��
���������͝����Ṳ���(hu��)�a(ch��n)����ϩ���ѵȸ��a(ch��n)Ʒ)
���E 2����D��ʾ���(sh��)�(y��n)�b�ã������ӟᣬֱ���o�͠����s����ֹ��
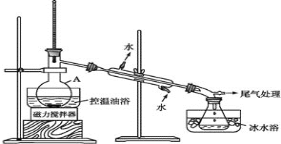
���E 3�����s��Һ�D(zhu��n)���Һ©�����ֳ��ЙC(j��)�ࡣ
���E 4�����ֳ����ЙC(j��)���D(zhu��n)���Һ©���������� 12mLH2O��12ml5%Na2CO3 ��Һ��12mLH2O ϴ�죬��Һ���ô֮a(ch��n)Ʒ���M(j��n)һ���ἃ�� 1-����顣
(1)�x�� A �����Q��_____��
(2)����(y��ng)�r(sh��)���ɵ���Ҫ�ЙC(j��)���a(ch��n)�� 2-������_______(���һ�N���ɽo��)
(3)���E 2 ���������ƿ?j��)?n��i)����������ˮ�����ڱ�ˮԡ�е�Ŀ����____��
(4)���E 1 �Н� H2SO4 ��ˮϡጣ�����s���Ҝغ��ټ� NaBr ��Ŀ����______�����E 4 ���� Na2CO3 ��Һϴ���Ŀ����_____��
(5)���E 4 ���M(j��n)һ���ἃ 1-�����ķ�����_________�����M(j��n)�д˲���֮ǰ��Ҫ �ßoˮMgBr2 ̎���֮a(ch��n)Ʒ����Ŀ����_____��
(6)1-�������һ���l����Ҳ�����Ƃ� 1-����,Ո(q��ng)�����ɮa(ch��n)�� 1-������Ƃ� 1-�����Ļ��W(xu��)����(y��ng)����ʽ________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�������f�����_���ǣ� ��
A. ����Ʊ�ʾ�����ԭ�Ӻ����\(y��n)��(d��ng)��܉�E
B. Fe3�������������Ų�ʽ��3s23p63d5
C. ���B(t��i)ԭ�ӵĺ�������Ų���[Kr]4d105s1��Ԫ�،���d�^(q��)
D. ���B(t��i)�~ԭ�ӵ�������܉����ʾʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��һ���ض��£��������]�����аl(f��)��N2(g)+3H2(g)![]() 2NH3(g)����(y��ng)������(y��ng)�����c����(y��ng)�r(sh��)�g���P(gu��n)ϵ��D��ʾ����(du��)�ɷNƽ���B(t��i)�¸��������ı��^�e(cu��)�`���ǣ� ��
2NH3(g)����(y��ng)������(y��ng)�����c����(y��ng)�r(sh��)�g���P(gu��n)ϵ��D��ʾ����(du��)�ɷNƽ���B(t��i)�¸��������ı��^�e(cu��)�`���ǣ� ��
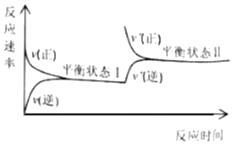
A.ƽ���B(t��i)��r(sh��)��c(H2)һ��СB.ƽ���B(t��i)��r(sh��)��c(NH3)һ����
C.ƽ�ⳣ��(sh��)Kһ�Ӵ�D.ƽ���B(t��i)��r(sh��)��v(��)һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�������y(AgBrO3)��KNO3���ܽ���S�ض�׃��������D��ʾ��


���з����e(cu��)�`���ǣ� ��
A.60��r(sh��)��AgBrO3�����Һ�ĝ����0.596%
B.�ض����ߕr(sh��)AgBrO3����KNO3�ܽ��ٶȶ��ӿ�
C.�ضȌ�(du��)AgBrO3���ܽ�ȵ�Ӱ푱Ȍ�(du��)KNO3�ܽ�ȵ�Ӱ푴�
D.KNO3������AgBrO3�����ؽY(ji��)���ķ�����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ����(sh��)�(y��n)�����ܶȞ�1.25 g/mL���|(zh��)����?j��n)?sh��)��36.5%�ĝ��}������240 mL 0.1 mol/L���}�ᣬՈ(q��ng)�ش����І��}��
(1)���}������|(zh��)������Ȟ�_________��
(2)���� 240 mL 0.1mol/L���}�ᡣ
��(y��ng)��ȡ���}���w�e/mL | ��(y��ng)�x������ƿ��Ҏ(gu��)��/mL |
______ | ______ |
(3)���ƕr(sh��)�������_�IJ��������(��ĸ��ʾ��ÿ��(g��)��ĸֻ����һ�� )_________
A. ��30 mLˮϴ�������(n��i)�ںͲ�����23�Σ�ϴ��Һ��ע������ƿ����ʎ
B. ����Ͳ���_��ȡ����ĝ��}����w�e����������У��ټ�������ˮ(�s30 mL)���ò�������������(d��ng)��ʹ���Ͼ���
C. ������s���}���ز�����ע������ƿ��
D. ������ƿ�w�o����ʎ���u��
E. �����z�^�ιܼ�ˮ��ʹ��Һ��Һ��ǡ���c�̶Ⱦ�����
F. �^�m(x��)������ƿ?j��)?n��i)С�ļ�ˮ��ֱ��Һ��ӽ��̶Ⱦ�12 cm̎
(4)��(sh��)�(y��n)������������r����(du��)�}����Һ�����|(zh��)��������к�Ӱ�(����ƫ��������ƫ����������׃��)?
������ϡ��}��ğ���δϴ��_________��
������ƿ��ԭ���������sˮ_________��
�۶��ݕr(sh��)�^��Һ�温ҕ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��ijͬ�W(xu��)��̽��Ԫ�����ڱ���Ԫ�����|(zh��)���f׃Ҏ(gu��)�ɣ��O(sh��)Ӌ(j��)������ϵ�Ќ�(sh��)�(y��n)��
��(1)���c���F���V���X��1 mol�քeͶ�뵽������ͬ��ȵ��}���У�ԇ�A(y��)�y(c��)��(sh��)�(y��n)�Y(ji��)����____________�c�}�ᷴ��(y��ng)��ҡ�
(2)��Na2S��Һ��ͨ���Ț���F(xi��n)�Sɫ���ᣬ���C��Cl�ķǽ����Ա�S��(qi��ng)������(y��ng)���x�ӷ���ʽ��____________________________��
��������D�b�ÿ��(y��n)�Cͬ����Ԫ�طǽ����Ե�׃��Ҏ(gu��)�ɡ�

(1)�x��B�����Q��_____________�������D�����Þ��ֹ______________________��
(2)��Ҫ�C���ǽ����ԣ�Cl>I-���tA�мӝ��}�ᣬB�м�KMnO4��KMnO4�c���}�᳣���·���(y��ng)�����Ț⣬C�мӵ���-�⻯⛻����Һ���^�쵽C����Һ__________________(��F(xi��n)��)�������C�����ĭh(hu��n)�����o(h��)���^�c(di��n)���]�����b��ȱ��β��̎���b�ã�����____________��Һ����β�⡣
(3)��Ҫ�C���ǽ����ԣ�![]() ���t��A�м��}�ᡢB�м�
���t��A�м��}�ᡢB�м�![]() ��C�м�
��C�м�![]() ��Һ���^�쵽C����Һ_____________
��Һ���^�쵽C����Һ_____________![]() ��F(xi��n)��
��F(xi��n)��![]() �������C�������е�ͬ�W(xu��)�J(r��n)���}����Г]�l(f��)�ԣ����M(j��n)��C�иɔ_��(sh��)�(y��n)����(y��ng)�ڃ��b���g�����b��____________��Һ��ϴ��ƿ��ȥ��
�������C�������е�ͬ�W(xu��)�J(r��n)���}����Г]�l(f��)�ԣ����M(j��n)��C�иɔ_��(sh��)�(y��n)����(y��ng)�ڃ��b���g�����b��____________��Һ��ϴ��ƿ��ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ����D�Dz��ֶ�����Ԫ��ԭ�Ӱ돽�cԭ����(sh��)���P(gu��n)ϵ�D�������f�����_���ǣ� ��
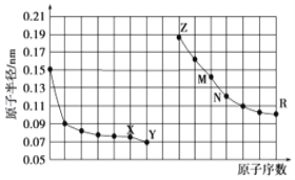
A.M����߃r(ji��)�����(du��)��(y��ng)ˮ�����ܷքe�cZ��R����߃r(ji��)�����(du��)��(y��ng)ˮ���ﷴ��(y��ng)
B.����߀ԭ��߀ԭR�ĺ�(ji��n)���x���Ƃ�R���|(zh��)
C.X��N�ɷNԪ�ؽM�ɵĻ��������c(di��n)�ܵ�
D.��(ji��n)���x�ӵİ돽��Z��X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ���±���Ԫ�����ڱ���һ���֣��û��W(xu��)���Z�ش����І��}��
��A | ��A | ��A | ��A | ��A | ��A | ��A | |
�� | �� | �� | �� | ||||
�� | �� | �� | �� | �� | �� |
��1���۵�Ԫ�ط�̖(h��o)��___��Ԫ�آ��c���γɻ���������ʽ��___��
��2�����^Ԫ�آٺ͢�ԭ�Ӱ돽��С����___������>������<������
��3��Ԫ�آ��x�ӽY(ji��)��(g��u)ʾ��D��___��
��4��Ԫ�آٺ͢��γɵĻ������к��еĻ��W(xu��)�I��___��
��5��Ԫ�آڡ��ݵ���߃r(ji��)�����(du��)��(y��ng)��ˮ����֮�g����(y��ng)���x�ӷ���ʽ��___��
��6�����I(y��)��ұ��Ԫ�آĆ��|(zh��)�Ļ��W(xu��)����ʽ��___��
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com