

分析 本實驗目的是測定鐵的質量分數,采取的方法是使樣品溶解、反應、最終生成氧化鐵,然后通過氧化鐵質量來求鐵的質量分數,
(1)由圖可知,操作I是將加入鹽酸反應的溶液稀釋成250.00mL溶液,故需要100mL的容量瓶,定容需要膠頭滴管;
(2)依據溶液配制過程和實驗步驟分析判斷選項中,各操作對濃度的影響分析判斷
(3)加氯水就是讓+2價鐵變為+3價;
(4)加熱分解所得的物質是Fe2O3,其質量為3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3質量為30g,根據化學式計算鐵元素的質量,再利用質量分數的定義計算原氧化鐵樣品中鐵元素的質量分數.
解答 解:(1)由圖可知,操作I是將加入鹽酸反應的溶液稀釋成250.00mL溶液,所用到的玻璃儀器除燒杯、玻璃棒外,需要250mL容量瓶,還需要用膠頭滴管定容,
故答案為:250mL容量瓶、膠頭滴管;
(2)依據溶液配制過程和實驗步驟分析判斷選項,操作可能使所配溶液濃度偏小:
①未洗滌燒杯和玻璃棒,溶質未全部轉移到容量瓶,濃度偏低,故①正確;
②定容時俯視容量瓶的刻度線,容量瓶中水未加到刻度線,濃度偏大,故②錯誤;
③配溶液前容量瓶中有少量蒸餾水對配置溶液濃度無影響,故③錯誤;
④搖勻后,發現液面低于刻度線后繼續加水至凹液面與刻度線相切,溶液濃度稀釋偏小,故④正確;
故答案為:①④;
(3)加氯水就是讓+2價鐵變為+3價,發生反應的離子方程式為:2Fe2++Cl2=2Fe3++2Cl-,
故答案為:2Fe2++Cl2=2Fe3++2Cl-;
(4)加熱分解所得的物質是Fe2O3,其質量為3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3質量為30g,依據鐵元素守恒計算鐵元素的質量分數=$\frac{\frac{30g}{160g/mol}×2×56}{50g}$100%=42%,
故答案為:42%;
點評 本題考查探究物質組成與含量,題目難度中等,涉及溶液配制、離子檢驗、對實驗操作的理解與實驗方案的評價、化學計算等知識,明確測定原理是解題的關鍵,是對所學知識的綜合運用,需要學生具有扎實的基礎與運用知識分析解決問題的能力.


 同步輕松練習系列答案
同步輕松練習系列答案 課課通課程標準思維方法與能力訓練系列答案
課課通課程標準思維方法與能力訓練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二甲醚(CH3OCH3)被稱為21世界的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:
二甲醚(CH3OCH3)被稱為21世界的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸濃度不變,使用量增大1倍 | B. | 鹽酸濃度增加1倍,但用量減至1/2 | ||
| C. | 將碳酸鈣固體改為碳酸鈣粉末 | D. | 加熱此反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
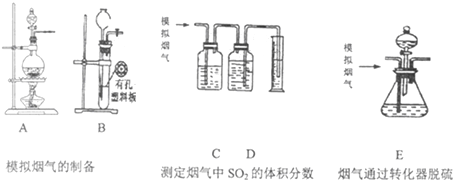
 研究硫及其化合物性質有重要意義.
研究硫及其化合物性質有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在混合物中加入足量濃硫酸,加熱、過濾 | |
| B. | 在混合物中加入足量NaOH溶液,過濾 | |
| C. | 用磁石將鐵粉吸出 | |
| D. | 在混合物中加入足量濃硝酸,加熱、過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通電\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com