
| A. | pH=13的NaOH溶液中含有的OH-的數為0.1 NA | |
| B. | Fe在少量Cl2中燃燒生成0.5 mol 產物,轉移的電子數為1 NA | |
| C. | 18g D2O中含有的質子數為9NA | |
| D. | 標準狀況下,含4 mol HCl的濃鹽酸與足量MnO2加熱反應可生成22.4 L氯氣 |
分析 A、溶液體積不明確;
B、根據鐵與氯氣反應后變為+3價來分析;
C、求出重水的物質的量,然后根據1mol重水中含10mol質子;
D、二氧化錳只能與濃鹽酸反應,一旦鹽酸變稀,反應即停止.
解答 解:A、溶液體積不明確,故溶液中的氫氧根的個數無法計算,故A錯誤;
B、鐵與氯氣反應后變為+3價,故當有0.5mol氯化鐵生成時,即有0.5mol鐵參與反應,則轉移1.5mol電子,即1.5NA個,故B錯誤;
C、18g重水的物質的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol質子,故0.9mol重水中含9mol質子,即9NA個,故C正確;
D、二氧化錳只能與濃鹽酸反應,一旦鹽酸變稀,反應即停止,故4molHCl不能完全反應,則生成氯氣的物質的量小于1mol,即體積小于22.4L,故D錯誤.
故選C.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的運用和物質的結構是解題關鍵,難度不大.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:選擇題
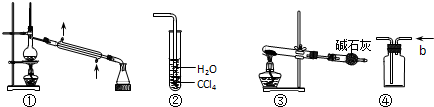
| A. | 裝置①常用于分離某些互溶的液體混合物 | |
| B. | 裝置②可用于吸收HCl氣體,并防止倒吸 | |
| C. | 以NH4HCO3為原料,裝置③可用于實驗室制備少量NH3 | |
| D. | 裝置④b口進氣,可用排空氣法收集H2、NO等氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1NaHC2O4溶液與0.1mol•L-1KOH溶液等體積混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液與10mL 0.1mol•L-1NaOH溶液混合后溶液呈堿性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常溫下,pH=2的HF溶液與pH=12的氫氧化鈉溶液等體積混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液與0.1mol•L-1HNO3等體積混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 白鐵(鍍鋅鐵皮)鍍層破損后鐵仍不易腐蝕 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自發進行,則該反應的△H>0 | |
| C. | MnS懸濁液中滴加少量CuSO4溶液可生成CuS沉淀,則Ksp(CuS)<Ksp(MnS) | |
| D. | 合成氨生產中將NH3液化分離,一定能加快正反應速率,提高H2的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
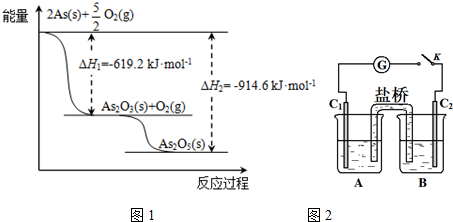
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,該碳酸飲料中KW的值大于純水中KW的值 | |
| B. | 該碳酸飲料中水的電離受到抑制 | |
| C. | 檸檬酸的電離會抑制碳酸的電離 | |
| D. | 打開瓶蓋冒出大量氣泡,是因為壓強減小,降低了CO2的溶解度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬的單質中,鋰的還原性最強 | |
| B. | 第IA族元素比第IIA族元素的金屬性強 | |
| C. | 同周期中,原子半徑隨原子序數的增大而減小(稀有氣體除外) | |
| D. | 隨著核電荷數的遞增,第三周期元素的氧化物對應的水化物的酸性逐漸增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
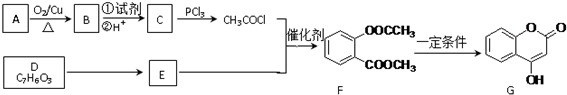
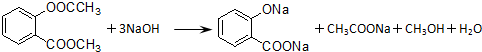 .
. .
.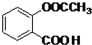 .
.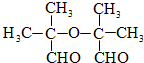 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com