
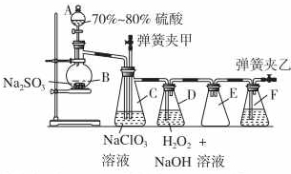
 裝置C中發生反應:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
裝置C中發生反應:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)分析 濃硫酸和Na2SO3制取SO2,裝置C中發生反應:2NaClO3+SO2═2ClO2+Na2SO4、裝置D中發生反應:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,裝置D有緩沖作用,可以作安全瓶,彈簧夾乙打開后,可以使裝置F中的NaOH溶液吸收尾氣;
(1)若裝置氣密性良好,水滴的速度會越來越慢,直到最后不滴;
彈簧夾乙打開后,可以使裝置F中的NaOH溶液吸收尾氣;
(2)裝置E可起到安全瓶的作用,即防止液體倒吸入裝置D中;
(3)檢驗堿液的存在可用酸堿指示劑;
(4)過量的SO2和過量的NaOH反應生成Na2SO3;Na2SO3與Ba(OH)2反應生成白色沉淀BaSO3.
解答 解:濃硫酸和Na2SO3制取SO2,裝置C中發生反應:2NaClO3+SO2═2ClO2+Na2SO4、裝置D中發生反應:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,裝置D有緩沖作用,可以作安全瓶,彈簧夾乙打開后,可以使裝置F中的NaOH溶液吸收尾氣;
(1)若裝置氣密性良好,關閉兩個彈簧夾,打開A中活塞,向A中注入水,水開始下滴,一段時間后,水不再下滴;
彈簧夾乙打開后,可以使裝置F中的NaOH溶液吸收尾氣,
故答案為:水開始下滴,一段時間后,水不再下滴;NaOH溶液;
(2)裝置E可起到安全瓶的作用,即防止液體倒吸入裝置D中;
故答案為:安全瓶(防止液體倒吸);
(3)氫氧化鈉過量,溶液顯堿性,能夠使石蕊變藍,能夠使酚酞變紅色;
故選:cd;
(4)一次實驗制備中,通過檢驗發現制備的NaClO2中含有NaOH、Na2SO3,出現這些雜質的可能原因是:過量的SO2和過量的NaOH反應生成Na2SO3;
Na2SO3與Ba(OH)2反應生成白色沉淀BaSO3,所以選取試劑為Ba(OH)2溶液;
故答案為:制備的SO2和裝置D中的NaOH同時過量;Ba(OH)2溶液.
點評 本題考查物質制備,為高頻考點,涉及氣體制備、氧化還原反應、基本操作、物質檢驗等知識點,明確實驗原理、物質性質、基本原理是解本題關鍵,熟悉各個裝置的作用及可能發生的反應,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1.0 | B. | 2.0 | C. | 13.0 | D. | 14.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
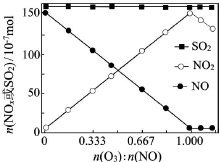 煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
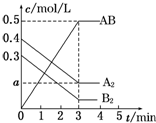 在一個容積為2L的密閉容器中,加入0.8mol A2氣體和0.6mol B2氣體,一定條件下發生如下反應:A2(g)+B2(g)═2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.下列說法正確的是( )
在一個容積為2L的密閉容器中,加入0.8mol A2氣體和0.6mol B2氣體,一定條件下發生如下反應:A2(g)+B2(g)═2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.下列說法正確的是( )| A. | 圖中a點的值為0.05 | B. | 該反應的平衡常數K=0.03 | ||
| C. | 平衡時A2的轉化率為62.5% | D. | 溫度升高,平衡常數K值增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6 g碳完全燃燒時放出熱量196.8 kJ | |
| B. | CO的燃燒熱△H=-283.0 kJ/mol | |
| C. | H2的燃燒熱△H=-241.8 kJ/mol | |
| D. | 制備水煤氣的反應熱△H=+131.3 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 尼古丁中C、H、N三種元素的質量比為5:7:1 | |
| B. | 吸煙有害健康 | |
| C. | CO比O2更易同血紅蛋白結合,會導致人體缺氧 | |
| D. | 尼古丁中氮元素的質量分數約為17.3% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com