
化學學科中的平衡理論主要內容包括:化學平衡、電離平衡、水解平衡和溶解平衡等四種.且均符合勒夏特列原理.請回答下列問題.
(1)一定溫度下,在一個固定容積的密閉容器中,可逆反應
A(g)+2B(g)
4C(g)△H>0 達到平衡時,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L.試確定B的起始濃度c(B)的取值范圍是
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改變條件重新達到平衡后,體系中C的質量分數增大,下列措施可行的是
C
C
A、增加C的物質的量 B、加壓 C、升溫 D、使用催化劑
(2)常溫下,某純堿(Na
2CO
3)溶液中滴入酚酞,溶液呈紅色.分析該溶液遇酚酞呈紅色原因(用離子方程式表示)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
(3)常溫下,取pH=2的鹽酸和醋酸溶液各100mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示.則圖中表示醋酸溶液中pH變化曲線的是
B
B
(填“A”或“B”).設鹽酸中加入的Zn質量為m
1,醋酸溶液中加入的Zn質量為m
2.則m
1<
<
m
2(選填“<”、“=”、“>”)
(4)在AgCl飽和溶液中尚有AgCl固體存在,當向溶液中加入0.1mol?L
-1的鹽酸時,溶液中c(Ag
+)
變小
變小
(選填“變大”、“變小”、“不變”)

 化學學科中的平衡理論主要內容包括:化學平衡、電離平衡、水解平衡和溶解平衡等四種.且均符合勒夏特列原理.請回答下列問題.
化學學科中的平衡理論主要內容包括:化學平衡、電離平衡、水解平衡和溶解平衡等四種.且均符合勒夏特列原理.請回答下列問題.

 化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:
化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題: 化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:
化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題: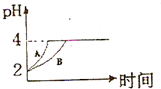 化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:常溫下,取 pH=2的鹽酸和醋酸溶液各100mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示.則圖中表示醋酸溶液中pH變化曲線的是
化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:常溫下,取 pH=2的鹽酸和醋酸溶液各100mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示.則圖中表示醋酸溶液中pH變化曲線的是