
| A. | 0.1mol/L的HNO3溶液中由水電離出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物質的溶液中由水電離的c(H+)=1×10-amol/L,若a<7,則pH一定為a | |
| C. | 在小蘇打水溶液中存在的電離平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,則c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
分析 A、0.1mol/L的HNO3溶液中氫離子濃度為0.1mol/L,依據離子積常數計算水電離處的氫離子濃度和氫氧根離子濃度相同;
B、向水中加入酸或堿抑制水電離,加入含有弱根離子的鹽促進水電離,根據某物質的溶液中由水電離出的c(H+)和純水中c(H+)相對大小判斷是促進水電離還是抑制水電離;
C、碳酸氫鈉是強電解質完全電離;
D、NH3•H2O和NH4Cl混合液pH=7,結合溶液電荷守恒分析,溶液中存在陰陽離子電荷總數相同.
解答 解:A、0.1mol/L的HNO3溶液中由水電離出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L<$\sqrt{{K}_{W}}$=10-7mol/L,故A正確;
B、某物質的溶液中由水電離的c(H+)=1×10-amol/L,若a<7,說明水電離出的氫離子濃度增大,則溶液是水解的鹽,若是弱酸強堿鹽,溶液PH=14-a,若是強酸弱堿鹽,PH=a,則pH不一定為a,故B錯誤;
C、碳酸氫鈉是強電解質完全電離,在小蘇打水溶液中存在的電離平衡有:HCO3-?CO32-+H+,H2O?H++OH-,故C錯誤;
D、NH3•H2O和NH4Cl混合液pH=7,則c(NH4+)=c(Cl-)>c(H+)=c(OH-),c(NH4+)≠c(NH3•H2O),故D錯誤;
故選A.
點評 本題考查了水的電離平衡影響因素分析判斷,電解質溶液中離子濃度大小比較方法,溶液中電荷守恒的應用,掌握基礎是關鍵,題目較簡單.


科目:高中化學 來源: 題型:選擇題
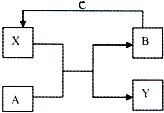 A、B、C、X和Y均為中學常見物質,其中A、B、C為單質,X、Y為化合物,它們在一定條件下可發生如右圖所示反應,下列說法不正確的是( )
A、B、C、X和Y均為中學常見物質,其中A、B、C為單質,X、Y為化合物,它們在一定條件下可發生如右圖所示反應,下列說法不正確的是( )| A. | 若X是光導纖維的主要成分,工業上常利用反應I制備B,Y的化學式為CO | |
| B. | 若A、B為生活中常見的兩種金屬單質,X是一種黑色磁性物質.X與氫碘酸反應的離子方程式為Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若組成A的元素在短周期中原子半徑最大(稀有氣體除外),以Y為電解質溶液,氣體B為燃料,C為氧化劑可構成燃料電池,工作一段時間后,Y溶液的pH增大 | |
| D. | 若常溫下A、B、C和X均為氣體,Y為固體,管道工人曾利用反應X檢驗氯氣管道是否漏氣,Y的電子式為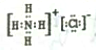 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 (a、b、c均大于零)下列說法不正確的是( )
(a、b、c均大于零)下列說法不正確的是( )| A. | 反應物的總能量高于生成物的總能量 | |
| B. | 斷開1 mol H-H鍵和1 mol I-I鍵所需能量大于斷開2 mol H-I鍵所需能量 | |
| C. | 斷開2 mol H-I鍵所需能量約為(c+b+a) kJ | |
| D. | 向密閉容器中加入2 mol H2和2 mol I2,充分反應后放出的熱量小于2a kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 消耗氧化銅的質量不同 | B. | 消耗鐵的質量相同 | ||
| C. | 消耗硫酸的質量相同 | D. | 生成硫酸亞鐵的質量不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2-淡黃色固體,可用做漂白劑 | B. | Na2O-白色固體,性質不穩定 | ||
| C. | NaHCO3-受熱易分解,可用做發酵粉 | D. | Na2CO3-性質穩定,可治療胃酸過多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com