
分析 (1)氧化還原反應中的,化合價升高值=化合價降低值=轉移電子數目;化合價升高的元素被氧化,化合價降低的元素所在的反應物是氧化劑,據此回答;
(2)根據n=$\frac{m}{M}$計算Cu的物質的量,根據方程式計算NO、HNO3的物質的量,再根據V=nVm計算NO體積;
(3)使生成的Cu(NO3)2中Cu2+全部轉化成沉淀,消耗氫氧根離子的物質的量是銅離子物質的量的2倍,據此回答.
解答 解:(1)該氧化還原反應中的,化合價升高的是銅元素,化合價降低的是硝酸中的氮元素,轉移電子數為6mol,雙線橋法表示電子轉移的方向和數目為: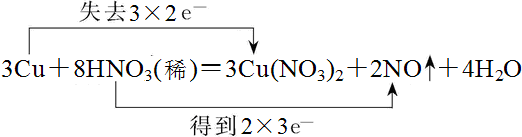 ,
,
故答案為: ;
;
(2)64gCu的物質的量為$\frac{6.4g}{64g/mol}$=0.1mol,
3 Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
3 8 2
0.1 x y
所以x=$\frac{0.8}{3}$mol,y=$\frac{0.2}{3}$mol
標況下生成NO體積為$\frac{0.2}{3}$mol×22.4L/mol=1.49L,
答:標況下生成NO體積為1.49L;
(3)使生成的Cu(NO3)2中Cu2+全部轉化成沉淀,消耗氫氧根離子的物質的量是銅離子物質的量的2倍,所以消耗氫氧化鈉的物質的量是0.2mol,設需要質量分數為40%密度為1.42g/ml的NaOH溶液體積為VmL,即$\frac{1.42V×40%}{40}$=0.2,解得V=14mL,
答:至少需要質量分數為40%密度為1.42g/ml的NaOH溶液體積是14mL.
點評 本題考查了氧化還原反應電子轉移和氧化還原反應的計算,難度中等,本題采取關系式計算,也可以利用電子轉移守恒計算.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,1L 1mol/LHF溶液中含HF分子數目為NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,將2mol CO2和6mol H2在一密閉容器中按照上述反應充分反應放出a kJ的熱量 | |
| C. | 78gNa2O2固體中含陰離子數目為NA | |
| D. | 25g質量分數68%的H2O2水溶液中含氧原子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
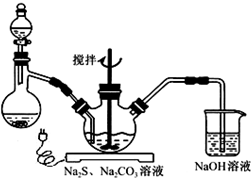 NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題:
NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 A、B、C、D、E五種物分別是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一種.常溫下進行下列實驗:
A、B、C、D、E五種物分別是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一種.常溫下進行下列實驗:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com