
過氧化鈣晶體[CaO2·8H2O]較穩定,呈白色,微溶于水,能溶于酸性溶液。廣泛應用于環境殺菌、消毒等領域。
★過氧化鈣晶體的制備
工業上生產CaO2·8H2O的主要流程如下: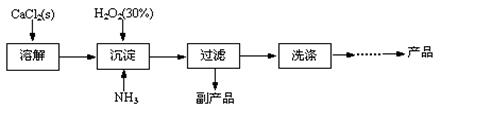
(1)用上述方法制取CaO2·8H2O的化學方程式是 。
(2)沉淀時常用冰水控制溫度在10℃以下和通入過量的NH3,其可能原因分別是
① ;② 。
★過氧化鈣晶體含量的測定
準確稱取0.3000g產品于錐形瓶中,加入30 mL蒸餾水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4標準溶液滴定至終點。重復上述操作兩次。H2O2和KMnO4反應的離子方程式為2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定終點觀察到的現象為 。
(4)根據表1數據計算產品中CaO2·8H2O的質量分數(寫出計算過程):
| 滴定次數 | 樣品的質量/g | KMnO4溶液的體積/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;(2)①溫度低可減少過氧化氫的分解,提高過氧化氫的利用率(或防止過氧化氫的分解);②通入過量的NH3使溶液呈堿性,抑制CaO2·8H2O的溶解(或提高產品的產率);(3)當滴入最后一滴KMnO4標準溶液后由無色變淺紅色,且半分鐘內不褪色。(4)82.91% 5 CaO2·8H2O ~ 5 H2O ~ 2 KMnO4
n(CaO2·8H2O)=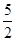 n(KMnO4)=
n(KMnO4)= 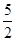 ×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的質量分數為:
×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的質量分數為: =82.91%
=82.91%
解析


 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案科目:高中化學 來源: 題型:填空題
鐵能在稀硝酸中溶解: →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上標出電子轉移的方向和數目。
25.該反應中被還原的元素是 ,還原劑是 。
26.若有0.1 mol鐵參加反應,被還原的HNO3為 mol。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮元素廣泛存在于自然界中,對人類生命和生活具有重要意義。含氮元素的化合物在工業生產和國防建設中都有廣泛的應用。
(1)氮元素原子核外有 個未成對電子,最外層有 種能量不同的電子。PH3分子的空間構型為 ,是 分子。(填極性或非極性)
(2)氮和磷是同主族元素,下列能說明二者非金屬性相對強弱的是 (填編號)
a.NH3比PH3穩定性強
b.硝酸顯強氧化性,磷酸不顯強氧化性
c.氮氣與氫氣能直接化合,磷與氫氣很難直接化合
d.氮氣常溫是氣體,磷單質是固體
亞硝酸鹽是食品添加劑中急性毒性較強的物質之一,可使正常的血紅蛋白變成正鐵血紅蛋白而失去攜帶氧的功能,導致組織缺氧。
(3)亞硝酸鈉溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色變為綠色,反應如下,補上缺項物質并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上題反應中每消耗0.6mol NO2-,轉移電子數為 。
(5)氮氧化物(NO和NO2)污染環境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反應時轉移電子0.1 mol,則反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
向盛有KI溶液的試管中加入少許CCl4后滴加氯水,CCl4層變成紫色。如果繼續向試管中滴加氯水,振蕩,CCl4層會逐漸變淺,最后變成無色。完成下列填空:
(1)寫出并配平CCl4層由紫色變成無色的化學反應方程式 。
(2)整個過程中的還原劑是 。
(3)把KI換成KBr,則CCl4層變為 色;繼續滴加氯水,CCl4層的顏色沒有變化。Cl2、HIO3、HBrO3氧化性由強到弱的順序是 。
(4)加碘鹽中含碘量為20~50 mg·kg-1。制取加碘鹽(含KIO3的食鹽)1 000 kg,若用KI與Cl2反應制KIO3,至少需要消耗Cl2 L(標準狀況,保留2位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用I2O5可消除CO污染或定量測定CO,反應為:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
則ΔH 1= (用含ΔH 2和ΔH 3的代數式表示)。
(2)不同溫度下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2molCO,測得CO2的體積分數φ(CO2)隨時間t變化曲線如圖。請回答:
①從反應開始至a點時的反應速率為v(CO)= ,b點時化學平衡常數Kb= 。
②d點時,溫度不變,若將容器體積壓縮至原來的一半,請在圖中補充畫出CO2體積分數的變化曲線。
③下列說法正確的是 。(填字母序號)
| A.容器內氣體密度不變,表明反應達到平衡狀態 |
| B.兩種溫度下,c點時體系中混合氣體的平均相對分子質量相等 |
| C.增加I2O5的投料量有利于提高CO的轉化率 |
| D.b點和d點的化學平衡常數:Kb<Kd |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
雄黃(As4S4)和雌黃(As2S3)是提取砷的主要礦物原料,二者在自然界中共生。根據題意完成下列填空:
(1)As2S3和SnCl2在鹽酸中反應轉化為As4S4和SnCl4并放出H2S氣體。若As2S3和SnCl2正好完全反應,As2S3和SnCl2的物質的量之比為 。
(2)上述反應中的氧化劑是 ,反應產生的氣體可用 吸收。
(3)As2S3和HNO3有如下反應:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,則反應中轉移電子的物質的量為 。若將該反應設計成一原電池,則NO2應該在 (填“正極”或“負極”)附近逸出。
(4)若反應產物NO2和11.2 L O2(標準狀況)混合后用水吸收全部轉化成濃HNO3,然后與過量的碳反應,所產生的CO2的量 (選填編號)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學實驗的微型化可有效減少污染,實現化學實驗綠色化的要求。某學生按下列操作做一個實驗:在一塊下襯白紙的玻璃片的不同位置分別滴加濃度為0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每種液滴彼此分開,圍成半徑小于表面皿的圓形(如圖所示),在圓心處放置2粒芝麻粒大小的KMnO4晶體,向KMnO4晶體中滴加一滴濃鹽酸,再立即將表面皿蓋好。[已知:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O]
(1)e處反應的離子方程式為 ,該反應中發生反應的氧化劑和還原劑的物質的量之比為 。
(2)b處的實驗現象為 ,d處的實驗現象為 。
(3)c處反應的化學方程式為 ,標準狀況下,當有0.224 L Cl2被NaOH溶液吸收后,轉移電子的物質的量為 mol。
(4)通過該實驗能否比較Cl2、FeCl3、KMnO4三種物質氧化性的強弱? (填“能”或“不能”),若能,其氧化性由強到弱的順序是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
電鍍廠鍍銅廢水中含有CN-和Cr2O72-,需要處理達標后才能排放。該廠擬定下列流程進行廢水處理:
回答下列問題:
(1)上述處理廢水流程中主要使用的方法是________。
(2)②中反應后無氣體放出,該反應的離子方程式為______________________________
__________________________________。
(3)步驟③中,每處理0.4 mol Cr2O72-時轉移電子2.4 mol,該反應的離子方程式為________________________________________________________________________。
(4)取少量待測水樣于試管中,加入NaOH溶液,觀察到有藍色沉淀生成,再加Na2S溶液,藍色沉淀轉化成黑色沉淀,請使用化學用語和文字解釋產生該現象的原因:
________________________________________________________________________。
(5)目前處理酸性Cr2O72-廢水多采用鐵氧磁體法。該法是向廢水中加入FeSO4·7H2O,將Cr2O72-還原成Cr3+,調節pH,Fe、Cr轉化成相當于FeⅡ[FeCr]O4(鐵氧磁體,羅馬數字表示元素價態)的沉淀。處理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列結論正確的是________。
| A.x=0.5,a=8 | B.x=0.5,a=10 |
| C.x=1.5,a=8 | D.x=1.5,a=10 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com