
【題目】某課外活動小組的同學,在實驗室做鋅與濃硫酸反應的實驗中,甲同學認為產生的氣體是二氧化硫,而乙同學認為除二氧化硫氣體外,還可能產生氫氣。為了驗證甲、乙兩位同學的判斷是否正確,丙同學設計了如圖所示實驗裝置(鋅與濃硫酸共熱時產生的氣體為X,且該裝置略去),試回答下列問題:
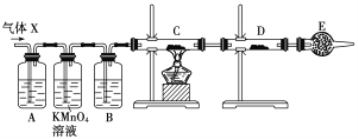
(1)上述反應中生成二氧化硫的化學方程式為______________________________。
(2)乙同學認為還可能產生氫氣的理由是__________________________________。
(3)丙同學在安裝好裝置后,必不可少的一步操作是________________________。
(4)A中加入的試劑可能是_____,作用是__________________________________;B中加入的試劑可能是_____,作用是__________________________________;E中加入的試劑可能是_____,作用是__________________________________。
(5)可以證明氣體X中含有氫氣的實驗現象是:C中:_________________________,D中:_________________________ 。如果去掉裝置B,還能否根據D中的現象判斷氣體X中有氫氣?_____ (填“能”或“不能”),原因是______________________________________________________。
【答案】Zn+2H2SO4(濃)==Z nSO4+SO2↑+2H2O 當Zn與濃H2SO4反應時,濃H2SO4濃度逐漸變稀,Zn與稀H2SO4反應可產生H2 檢查裝置的氣密性 品紅溶液 檢驗SO2 濃H2SO4 吸收水蒸氣 堿石灰 防止空氣中水蒸氣進入D中 黑色(CuO)變成紅色(Cu) 白色粉末變成藍色 不能 因為混合氣體中含H2O,會干擾H2的檢驗
【解析】
濃硫酸具有強氧化性,與Zn反應Zn+2H2SO4(濃)=ZnSO4+SO2↑+2H2O,隨著反應的進行,濃硫酸變為稀硫酸,可能發生Zn與稀硫酸反應:Zn+H2SO4=ZnSO4+H2↑,驗證H2的存在,通過H2還原氧化銅進行;
(1)生成SO2,發生的化學方程式為Zn+2H2SO4(濃)=ZnSO4+SO2↑+2H2O;
(2)隨著反應進行,濃硫酸的濃度降低,Zn與稀硫酸發生Zn+H2SO4=ZnSO4+H2↑,產生氫氣;
(3)需要通入氣體,因此實驗必不可缺少的一步操作是檢驗裝置的氣密性;
(4)根據實驗目的,需要檢驗SO2、H2,檢驗SO2:利用SO2能使品紅溶液褪色,H2不行,因此裝置A中盛放的試劑是品紅,作用是檢驗SO2存在;酸性高錳酸鉀溶液作用是除去SO2,防止SO2干擾后續實驗;檢驗H2的存在,氫氣還原CuO,需要檢測H2O,因此裝置B中盛放的試劑為濃硫酸,作用是吸收水蒸氣,干燥氫氣;C裝置盛放CuO,D裝置盛放無水CuSO4,E裝置盛放的試劑可能為堿石灰,防止空氣中水蒸氣進入D裝置,干擾對H2O的檢驗;
(5)根據(4),證明氣體中有氫氣,C中現象是黑色變為紅色,D中:白色粉末變成藍色;如果去掉B裝置,從高錳酸鉀溶液中出來的氣體帶有水蒸氣,對H2的檢驗產生干擾,因此去掉B裝置,不能根據D裝置現象判斷是否含有H2。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列物質所含分子數最少的是
A. 標準狀況下4.48L二氧化碳 B. 3.2g氧氣
C. 含0.4NA個分子的氫氣 D. 0.5mol氮氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種優質燃料,在工業上常用CO和H2合成甲醇,反應方程式為CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列問題:
(1)計算CO(g)+2H2(g) ![]() CH3OH(g)的反應熱△H4=________________。
CH3OH(g)的反應熱△H4=________________。
(2)若在絕熱、恒容的密閉容器中充入1 mol CO、2 mol H2,發生CO(g)+2H2(g) ![]() CH3OH(g)反應,下列示意圖正確且能說明反應在進行到t1時刻為平衡狀態的是________(填選項字母)。
CH3OH(g)反應,下列示意圖正確且能說明反應在進行到t1時刻為平衡狀態的是________(填選項字母)。

(3)T1℃時,在一個體積為5 L的恒容容器中充入1 mol CO、2 mol H2,經過5 min達到平衡,CO的轉化率為0.8,則5 min內用H2表示的反應速率為v(H2)=_______________________。T1℃時,在另一體積不變的密閉容器中也充入1 mol CO、2 mol H2,達到平衡時CO的轉化率為0.7,則該容器的體積______5 L(填“>”“<”或“=”);T1℃時,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常數K=____________________________。
CH3OH(g)的平衡常數K=____________________________。
(4)為了提高燃料的利用率可以將甲醇設計為燃料電池,寫出KOH作電解質溶液時,甲醇燃料電池的負極反應式:_________________________。該電池負極與水庫的鐵閘相連時,可以保護鐵閘不被腐蝕,這種電化學保護方法叫做___________。
(5)含有甲醇的廢水隨意排放會造成水污染,可用ClO2將其氧化為CO2,然后再加堿中和即可。寫出處理甲醇酸性廢水過程中,ClO2與甲醇反應的離子方程式:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】經測定谷氨酸的同系物——天門冬氨酸中含氧百分率為48.1%,若用0.01mol天門冬氨酸與足量鹽酸反應,將所得的鹽配成100mL溶液,取10mL用0.2mol/L燒堿溶液滴定,當完全反應時耗堿液15mL。則天門冬氨酸的相對分子質量為______________,分子式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2a L Al2(SO4)3和(NH4)2SO4的混合溶液分為兩等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量強堿并加熱可得到c mol NH3氣體,則原混合溶液中的Al3+濃度(mol/L)為( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有甲烷、乙烯、苯、甲醇、乙酸等有機物。
(1)寫出上述物質中能發生下列指定反應的化學方程式。
與濃硝酸發生取代反應:_________________________;
與Cl2發生光照下的反應(只寫一個反應):___________________________;
與甲醇(CH3OH)發生酯化反應:____________________。
(2)完全燃燒等物質的量的上述物質,生成物中H2O和CO2的物質的量相等的是________,消耗O2的量相等的是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】山梨酸是目前國際上公認的安全防腐劑。山梨酸可由山梨醛經如下過程合成:
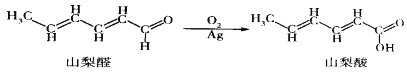
下列有關說法正確的是( )
A. 山梨酸與CH2=CH-COOH互為同系物
B. 山梨醛能發生取代、氧化、還原和加成反應
C. 與山梨酸含有相同官能團且含一個五元環的山梨酸的同分異構體有5種
D. 山梨酸分子中處于同一平面的原子最多13個
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com