
| 實驗序號 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 鹽酸體積(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 樣品質量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的體積(mL) | 672 | 840 | 896 | 672 |
分析 (1)對比Ⅰ、Ⅱ、Ⅲ可知,隨著樣品質量增加,生成二氧化碳的體積逐漸增大,說明Ⅰ、Ⅱ中鹽酸過量,Na2CO3和NaHCO3的完全反應,設出Ⅰ中碳酸鈉、碳酸氫鈉的物質的量,然后根據總質量、生成二氧化碳的量列式計算;
(2)根據實驗Ⅲ、Ⅳ可知,Ⅳ中鹽酸不足,碳酸鈉優先反應生成碳酸氫鈉,然后碳酸氫鈉與鹽酸反應生成二氧化碳,根據(1)的計算結果計算出碳酸鈉的物質的量,再根據反應HCl+Na2CO3=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑計算出HCl的物質的量,最后根據c=$\frac{n}{V}$計算出該鹽酸的濃度.
解答 解:(1)結合Ⅰ、Ⅱ、Ⅲ可知,隨著樣品質量增加,生成二氧化碳的體積逐漸增大,說明Ⅰ、Ⅱ中鹽酸過量,Na2CO3和NaHCO3的完全反應,
設出Ⅰ中Na2CO3、NaHCO3的物質的量分別為x、y,
則①106x+84y=2.96、②x+y=$\frac{0.672L}{22.4L/mol}$=0.03mol,聯立①②解得:x=0.02mol、y=0.01mol,
所以樣品中物質的量之比n(Na2CO3):n(NaHCO3)=0.02mol:0.01mol=2:1,
故答案為:2:1;
(2)根據實驗Ⅲ、Ⅳ可知,Ⅳ中鹽酸不足,Na2CO3優先反應生成NaHCO3,設6.66g樣品中含有碳酸鈉、碳酸氫鈉的物質的量分別為2x、x,則106×2x+84x=6.66,解得:x=0.0225mol,即6.66g樣品中含有0.045mol碳酸鈉、0.0225mol碳酸氫鈉,
將樣品加入鹽酸中,先發生反應HCl+Na2CO3=NaHCO3+NaCl,0.045mol碳酸鈉完全反應消耗HCl的物質的量為0.045mol,碳酸鈉完全反應后發生再發生反應NaHCO3+HCl=NaCl+H2O+CO2↑,生成標準狀況下672L二氧化碳消耗HCl的物質的量為:n(HCl)=n(CO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,
所以30mL鹽酸中含有HCl的物質的量為:0.045mol+0.03mol=0.075mol,該鹽酸的物質的量濃度為:c(HCl)=$\frac{0.075mol}{0.03L}$=2.5mol/L,
故答案為:2.5mol/L.
點評 本題考查了混合物反應的計算,題目難度中等,正確判斷反應物過量情況為解答關鍵,注意掌握討論法在化學計算中的應用,試題培養了學生的分析能力及化學計算能力.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:解答題
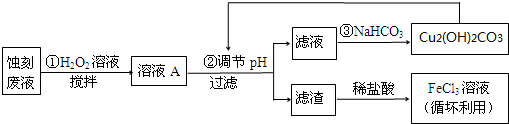
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 開始沉淀時 | 4.7 | 7.0 | 1.9 |
| 沉淀完全時 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
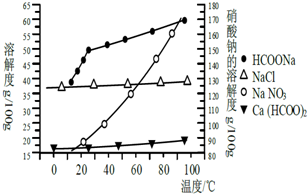 甲酸鈣廣泛用于食品、化工、石油等工業生產上,300~400℃左右分解.
甲酸鈣廣泛用于食品、化工、石油等工業生產上,300~400℃左右分解.| 金屬 離子 | 開始沉淀 的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
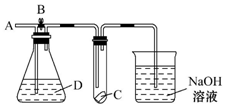 如圖所示,A處通入干燥的Cl2,打開B閥后,C處的紅布條逐漸褪色,關閉B閥時,C處的紅布條看不到明顯現象,則D瓶中裝的是( )
如圖所示,A處通入干燥的Cl2,打開B閥后,C處的紅布條逐漸褪色,關閉B閥時,C處的紅布條看不到明顯現象,則D瓶中裝的是( )| A. | 濃硫酸 | B. | NaOH溶液 | C. | 濃鹽酸 | D. | 飽和NaCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑤ | B. | ③⑥ | C. | ①② | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分離對硝基甲苯和鄰硝基甲苯:蒸餾 | |
| B. | 除去甲基丙烯酸甲酯中少量甲醇:蒸餾 | |
| C. | 除去漠苯中少量水:分液 | |
| D. | 從粗產品中提純苯甲酸鈉:重結晶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2在反應中只作氧化劑 | |
| B. | 由于Na2O2與H2O反應放出熱量和氧氣,所以脫脂棉劇烈燃燒 | |
| C. | Na2O2與H2O反應中有氫氧化鈉生成,Na2O2是典型的堿性氧化性 | |
| D. | Na2O2與H2O反應中有氧氣生成,可用于防毒面具上 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
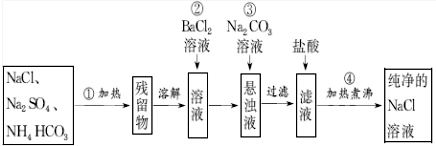
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com