

分析 (1)亞鐵離子和碳酸氫根離子發生雙水解反應生成CO2;
(2)結合假設1、2可知白色固體可能是Fe(OH)2和FeCO3的混合物;
(3)FeSO4和NaHCO3反應生成Fe(OH)2沉淀、二氧化碳和硫酸鈉;二價鐵不穩定,易被氧氣氧化而干擾實驗;堿性條件下,亞鐵離子生成Fe(OH)2沉淀;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不穩定,極易被氧化生成Fe(OH)3;FeCO3在干燥空氣中穩定,潮濕環境中需較長時間才能被氧化為Fe(OH)3,通入空氣后根據白色固體變色時間長短判斷白色沉淀成分.
解答 解:(1)亞鐵離子和碳酸氫根離子發生雙水解反應生成CO2,所以生成的氣體是CO2,故答案為:CO2;
(2)白色固體也可能是Fe(OH)2和FeCO3的混合物,所以假設3為:白色固體是Fe(OH)2和FeCO3,故答案為:Fe(OH)2和FeCO3;
(3)FeSO4和NaHCO3反應生成Fe(OH)2沉淀、二氧化碳,根據元素守恒知還生成硫酸鈉,反應方程式為FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;
二價鐵不穩定,易被氧氣氧化而干擾實驗,所以經煮沸后冷卻的蒸餾水配制FeSO4和NaHCO3溶液的目的是除去水中溶解的氧氣,防止生成的氫氧化亞鐵被迅速氧化;
反應體系進行了無氧處理并且碳酸氫鈉水解提供了堿性環境,所以白色沉淀中一定含有氫氧化亞鐵,
故答案為:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;除去水中溶解的氧氣,防止生成的氫氧化亞鐵被迅速氧化;不同意;反應體系進行了無氧處理,并且碳酸氫鈉水解提供了堿性環境;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不穩定,極易被氧化生成Fe(OH)3;FeCO3在干燥空氣中穩定,潮濕環境中需較長時間才能被氧化為Fe(OH)3,通入空氣后根據白色固體變色時間長短判斷白色沉淀成分,所以其實驗步驟、預期現象和結論為:向生成的白色沉淀的試管中通入空氣,若白色沉淀迅速變成灰綠色,最后變為紅褐色,則假設2不成立;若白色沉淀短時間內不變色,則假設2成立,
故答案為:向生成的白色沉淀的試管中通入空氣,若白色沉淀迅速變成灰綠色,最后變為紅褐色,則假設2不成立;若白色沉淀短時間內不變色,則假設2成立.
點評 本題考查性質實驗方案設計,題目難度中等,側重考查學生的分析、判斷及實驗操作能力,明確實驗原理及物質性質是解本題關鍵,難點是(4)實驗方案設計,要利用物質性質的區別設計方案.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:多選題
| A. | 上述測定不能達到實驗目的 | B. | 剩余的7.48g金屬為銅 | ||
| C. | 共生成NO氣體 0.04mol | D. | 該合金中銅的質量分數為69.2% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
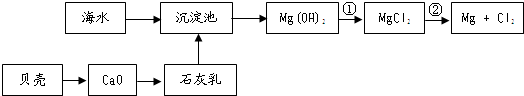
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
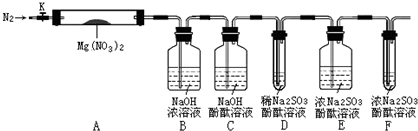
 ,步驟Ⅱ中,通入一段時間N2的目的是避免對分解產物O2的檢驗產生干擾.
,步驟Ⅱ中,通入一段時間N2的目的是避免對分解產物O2的檢驗產生干擾.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
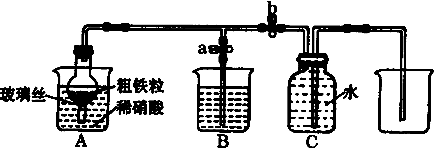
| 實驗步驟 | 操作 | 現象與結論 |
| 第一步 | 取少量液體裝于試管,向試管中滴入幾滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,則說明含有Fe2+,若無明顯變化,則說明不含Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
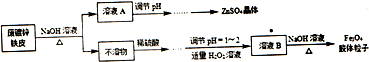
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲酸乙酯的結構簡式:HCOOCH2CH3 | |
| B. | 質子數為53,中子數為75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的電子式: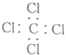 | |
| D. | 間甲基苯酚: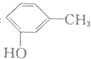 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com