
[化學——選修3: 物質結構與性質](15分)
Sn是人類最早使用的元素之一,能形成SnCl2,SnCl4兩種氯化物,SnCl2常溫下為白色晶體,具有一維鏈狀的聚合結構,氣態時以單分子形式存在,而SnCl4常溫下為無色液體。白錫和灰錫是Sn的兩種同素異形體,白錫的晶體結構中Sn原子的配位數為4和6,灰錫的晶體結構與金剛石的晶體結構相似。白錫的密度大于灰錫的密度。
(1)Sn元素價層電子排布式為 。
(2)SnCl2的一維鏈狀聚合結構如圖所示,在分子結構中標出
所含有的配位鍵。其固體分子及氣體分子中Sn的雜化方式為 。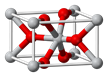
(3)SnCl4分子的空間構型為 ,SnCl4與CCl4中
沸點較高的是 。
(4)錫的某種氧化物的晶胞如右圖,其化學式為 。
(5)解釋白錫分子的密度大于灰錫的密度的原因: 。
(6)若灰錫的晶胞邊長為a pm,計算灰錫的密度 為 。
(1)5s25p2(2分)
(2) 圖略 (2分) sp3、、 sp2(各1分)
(3)正四面體;SnCl4(各1分)
(4)SnO2(2分)
(5)配位數大,空間利用率大(2分)
(6)952/NA(a×10—10)3(3分)
解析試題分析:(1)Sn元素是50號元素,最外層電子是4個,位于元素周期表的第五周期,第四主族,所以價層電子排布式為5s25p2;
(2)Sn元素的5p軌道上有空軌道,Cl原子中有孤對電子,所以1個SnCl2分子中的Sn與另一分子中的Cl原子可以形成配位鍵,從而形成一維鏈狀聚合結構,配位鍵的形式是從提供孤對電子的一方指向提供空軌道的一方;固體分子SnCl2中存在一個配位鍵,所以Sn的價層電子對數是3+1/2(4-2×1)=4,所以是sp3雜化;氣態時以單分子形式存在,所以Sn的價層電子對數是2+1/2(4-2×1)=3, sp2雜化;
(3)SnCl4分子中Sn的價層電子對數是4+1/2(4-4×1)=4,空間構型是正四面體型;SnCl4與CCl4都是分子晶體,所以相對分子質量大的分子間作用力大,沸點較高,所以SnCl4的沸點較高;
(4)錫的某種氧化物的晶胞中Sn原子8頂點各1個和中心1個,共是8×1/8+1=2個,O原子分別在上下2個底面各2個和體內的2個,共是4×1/2+2=4,所以Sn與O的原子個數比是2:4=1:2,化學式為SnO2
(5)白錫的晶體結構中Sn原子的配位數為4和6,灰錫的晶體結構與金剛石的晶體結構相似,配位數是4,所以白錫晶體的配位數大,空間利用率大,單位體積擁有的Sn原子多,密度大;
(6)灰錫晶胞中Sn原子的個數是8,與金剛石晶胞中C原子個數相同,所以灰錫的密度=m/V=8×119/NA/(a×10-10)3=952/NA(a×10—10)3g/cm3
考點:考查原子結構、物質結構的判斷,雜化軌道的判斷,晶胞的計算


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:填空題
有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為40%,且其核內質子數等子中子數。R是由A、D兩元素形成的離子化合物,其中A+與D2一離子數之比為2:1。請回答下列問題:
(1)A元素形成的晶體內晶體類型應屬于 (填寫“六方”、“面心立方”或“體心立方”)堆積,空間利用率為 。
(2)C3-的電子排布式為 ,在CB3分子中C元素原子的原子軌道發生的是 雜化,CB3分子的VSEPR模型為 。
(3)C的氫化物在水中的溶解度如何 ,為什么具有這樣的溶解性 。
(4)D元素與同周期相鄰元素的第一電離能由大到小的關系是:
(用元素符號表示);用一個化學方程式說明B、D兩元素形成的單質的氧化性強弱: 。
(5)如圖所示是R形成的晶體的晶胞,該晶胞與CaF2晶胞結構相似,設晶體密度是p g·cm-3試計算R晶體中A+和D2-最短的距離 。
(阿伏加德羅常數用NA表示,只寫出計算式,不用計算)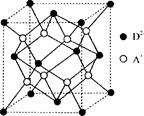
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)下表為元素周期表的一部分,參照元素①~⑦在表中的位置,請用化學用語
回答下列問題:
(1)④、⑤、⑦的原子半徑由大到小的順序為_______(用元素符號表示,下同)。
(2)⑥和⑦的最高價含氧酸的酸性強弱為_______>_______。
(3)①、②兩種元素按原子個數之比為1:1組成的常見液態化合物,在酸性溶液中能將Fe+氧化,寫出該反應的離子方程式_______。
(4)由表中元素形成的物質可發生如圖中的反應,
其中B、C、G是單質,B為黃綠色氣體,D溶液顯堿性。
①寫出D溶液與G反應的化學方程式______________.
②寫出檢驗A溶液中溶質的陰離子的方法:______________.
③常溫下,若電解1 L 0.1 mol/L的A溶液,一段時間后測得溶液pH為12(忽略溶液體積變化),則該電解過程中轉移電子的物質的量為_______mol。
④若上圖中各步反應均為恰好完全轉化,則混合物X中含有的物質有_______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)Q、W、X、Y、Z是原子序數依次增大的短周期元素,X、Y是金屬元素,Q、W、Z是非金屬元素。五種元素核電荷數之和為55,對應原子最外層電子數之和為21。W、Z最外層電子數相同,但Z的核電荷數是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高價氧化物對應的水化物可以發生反應生成鹽和水,請寫出該反應的離子方程式: 。
(3)X單質能在W單質中燃燒可生成化合物R,R的電子式 ___,該物質所含有的化學鍵的類型為 。
(4)Z的氫化物與W的氫化物發生反應生成Z單質和水,寫出其化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)下表中列出五種短周期元素X、Y、Z、W、T的信息。
| 元素 | 相關信息 |
| X | 基態原子最外層電子排布為nsnnpn+1 |
| Y | 其原子L層電子數是K層3倍 |
| Z | 其單質能與冷水劇烈反應,生成的陰陽離子電子數相同 |
| W | 其單質在Y2中燃燒,發出明亮的藍紫色火焰 |
| T | 其最高正價與最低負價的代數和為6 |
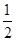 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D是元素周期表中前36號元素,它們的核電荷數依次增大。第二周期元素A原子的核外成對電子數是未成對電子數的2倍且有3個能級,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素。D是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿。請回答下列問題:
(1)A、B、C的第一電離能由小到大的順序是________(用對應的元素符號表示);D原子的基態電子排布式為___________________________________。
(2)A的最高價氧化物對應的水化物分子中,其中心原子采取________雜化;BC的空間構型為________(用文字描述)。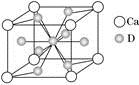 (3)1 mol AB-中含有的π鍵個數為________。
(3)1 mol AB-中含有的π鍵個數為________。
(4)如圖是金屬Ca和D所形成的某種合金的晶胞結構示意圖,則該合金中Ca和D的原子個數比是________。
(5)鑭鎳合金與上述合金都具有相同類型的晶胞結構XYn,它們有很強的儲氫能力。已知鑭鎳合金LaNin晶胞體積為9.0×10-23 cm3,儲氫后形成LaNinH4.5合金(氫進入晶胞空隙,體積不變),則LaNin中n=________(填數值);氫在合金中的密度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(13分)短周期元素Q、R、T、W在元素周期表中的位置如右圖所示,其中T所處的周期序數與主族序數相等,請回答下列問題: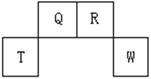
(1)W在周期表中的位置是 , Q、R、T三種元素原子的半徑從大到小排列順序 (用元素符號表示),Q的最高價氧化物的電子式 ,R氣態氫化物分子的結構式為 ;
(2)元素的原子得電子能力:Q W(填“強于”或“弱于”);
(3)原子序數比R多8的元素形成的一種常見氣態氫化物的沸點 (填“高”或“低”)于R的的常見氣態氫化物;
(4)T、Q、R、W的單質中,固態時屬于原子晶體的是 (填名稱);
(5)現有8種元素的性質、數據如下表所列,它們屬于短周期:請指出R元素在下表中的對應編號 ,與T同周期且最高價氧化物的水化物堿性最強的元素在下表中的對應編號 。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半徑(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合價 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有A、B、C、D四種短周期主族元素,A元素形成的—2價陰離子比氦原子的核外電子數多8個,B元素與A元素形成的一種化合物為淡黃色固體,該固體遇到空氣能生成A的單質;C為原子核內有12個中子的金屬元素,當2.4克C與足量熱水反應時,在標準狀況下放出氣體2.24L,C形成正二價陽離子;D元素原子的M層上有7個電子。
(1)寫出B、C兩種元素的元素符號:B ,C ;
(2)畫出A2-的離子結構示意圖: , 指出D在周期表的位置: ;
(3)寫出B的呈淡黃色的化合物與CO2反應的化學方程式: ;
(4)比較D的氣態氫化物與H2S和HF的穩定性由強到弱的順序: (用化學式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)有X、Y、Z三種短周期元素,X的氣態氫化物化學式為H2X,此氫化物的分子量與X最高價氧化物的分子量之比為17:40,X原子核內質子數與中子數相等,Y與X可以形成離子化合物Y2X,Y的陽離子電子層結構與Ne相同,Z與X同周期,其氣態單質是雙原子分子,兩原子共用1對電子。試回答:
(1)寫出各元素符號:X 、Y 、Z 。
(2)X離子的結構示意圖為 。X與Y形成的離子化合物的電子式為 , Z和氫形成的化合物的電子式為 。
(3)Y單質在空氣中燃燒的化學方程式為 ,生成物與水反應的化學方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com