
如圖是溫度和壓強對反應2Z(g) x+Y的影響示意圖,圖中橫坐標表示溫度,縱
x+Y的影響示意圖,圖中橫坐標表示溫度,縱 坐標表示平衡混合氣體中z的體積分數。則下列敘述正確的是
坐標表示平衡混合氣體中z的體積分數。則下列敘述正確的是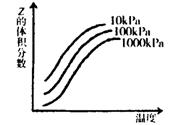
| A.上述可逆反應的正反應△H>0 |
| B.X、Y必須均為氣態物質 |
| C.若要提高Z的轉化率,可向反應體系中加入合適的催化劑 |
| D.若保持恒溫恒容的條件,向平衡體系中通入He,容器內壓強增大,但正逆反應速率都不變 |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 反應過程 | 化學方程式 | 焓變△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |

查看答案和解析>>
科目:高中化學 來源: 題型:
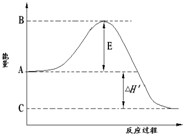 合成氨工業是極為重要的化學工業,當今對合成氨工業的研究仍然充滿活力.其合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列問題:
合成氨工業是極為重要的化學工業,當今對合成氨工業的研究仍然充滿活力.其合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列問題:| 1 |
| 3 |
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
查看答案和解析>>
科目:高中化學 來源:2012年浙江省高考化學試卷(解析版) 題型:解答題
| 反應過程 | 化學方程式 | 焓變△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |

查看答案和解析>>
科目:高中化學 來源: 題型:
反應:L(s)+aG(g)![]() bR(g) 達到平衡時,溫度和壓強對該反
bR(g) 達到平衡時,溫度和壓強對該反
應的影響如右圖所示:圖中壓強p1>p2,x軸表示溫度,y軸
表示平衡混合氣中G的體積分數。據此可判斷:
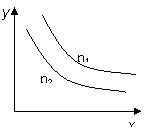 |
A.上述反應是放熱反應 B.上述反應是吸熱反應
C.a>b D.1+a<b
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com