
分析 由不同非金屬元素形成的化學鍵為極性鍵;由同種非金屬元素形成的化學鍵為非極性鍵;只含非極性鍵的分子為非極性分子;若分子含有極性鍵,但結構對稱,正負電荷的中心重合,則為非極性分子;極性分子中正負電荷的中心不重合,具有一定的極性,以此來解答.
解答 解:HF中含有極性鍵,正負電荷的中心不重合,屬于極性分子,分子極性最大;
H2O中含有極性鍵,空間結構為折線型,屬于極性分子;
NH3中含有極性鍵,空間結構為三角錐形,正負電荷的中心不重合,屬于極性分子;
CH4中含有極性鍵,空間結構為正四面體,正負電荷的中心重合,屬于非極性分子;
N2中只含非極性鍵,屬于非極性分子;
CO2含有極性鍵,空間結構為直線型,屬于非極性分子;
HI中含有極性鍵,正負電荷的中心不重合,屬于極性分子;
(1)以非極性鍵結合的非極性分子是N2;故答案為:N2;
(2)以極性鍵相結合,具有正四面體結構的非極性分子是CH4;故答案為:CH4;
(3)以極性鍵相結合,具有三角錐型結構的極性分子是NH3;故答案為:NH3;
(4)以極性鍵相結合,具有折線型結構的極性分子是H2O;故答案為:H2O;
(5)以極性鍵相結合,而且分子極性最大的是HF;故答案為:HF;
(6)元素的非金屬性越強,其氫化物越穩定,幾種氫化物中最不穩定的是HI,所以以極性鍵相結合,分子最不穩定的是HI,故答案為:HI.
點評 本題考查極性鍵和非極性鍵,熟悉常見元素之間的成鍵是解答本題的關鍵,注意化學鍵、空間構型與分子的極性的關系來分析解答即可,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | M層上電子數是K層上電子數的3倍 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 元素最高正價是+7價 |
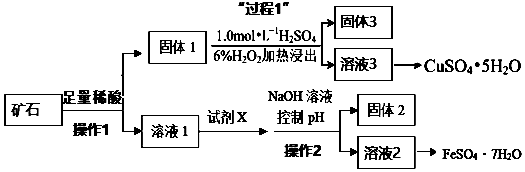
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,4g H2含有的分子數為 2NA | |
| B. | 8g H2O在標準狀況下的體積是22.4L | |
| C. | 2.3g金屬鈉變為鈉離子時失去的電子數為NA | |
| D. | 17g氨氣所含電子數目為8NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
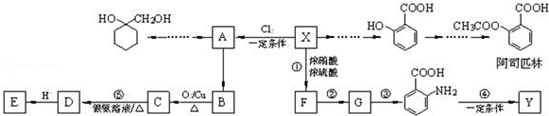
 $\stackrel{MnO(H)}{→}$
$\stackrel{MnO(H)}{→}$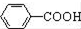
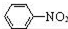 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$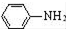 (苯胺,易被氧化)
(苯胺,易被氧化) .
.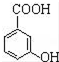 有多種同分異構體,寫出同時符合下列4個條件它的同分異構體的結構簡式:
有多種同分異構體,寫出同時符合下列4個條件它的同分異構體的結構簡式: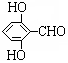 、
、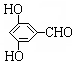 .
.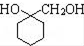 的流程圖:
的流程圖: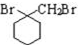 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$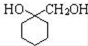
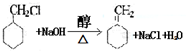 .
.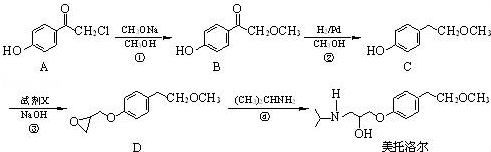
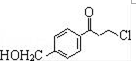 為原料制備
為原料制備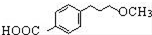 的合成路線流程圖(無機試劑任用).
的合成路線流程圖(無機試劑任用).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
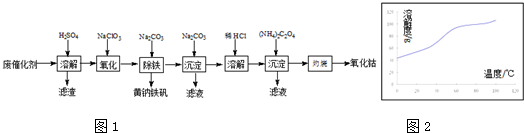
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO的結構式:H-Cl-O | B. | 氨氣分子的球棍模型: | ||
| C. | 乙烯的結構簡式:CH2CH2 | D. | 硫化氫分子的電子式: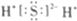 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
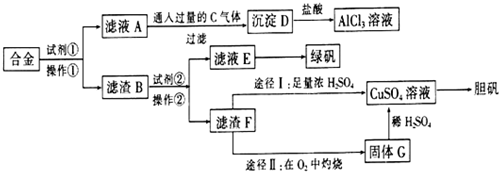
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com