
分析 (1)根據溴的原子的質子數為35,由能量最低原理來書寫電子排布式;
(2)根據相對分子質量來判斷范德華力,再比較物質的沸點;
(3)利用F的電負性及氫鍵來解釋;
(4)根據價層電子對結構模型來分析I3+的空間構型;
(5)RbICl2加熱時會分解為晶格能相對較大的鹵化物A和鹵素互化物或鹵素單質,利用半徑來分析晶格能相對較大的鹵化物;
(6)非金屬性越強,則對應最高價含氧酸的酸性就強,同種元素的含氧酸,利用非羥基氧個數來判斷酸性.
解答 解:(1)溴的原子的質子數為35,核外電子數為35,由能量最低原理其電子排布式為[Ar]3d104s24p5,故答案為:[Ar]3d104s24p5;
(2)因相對分子質量BrI>ICl>Cl2 ,則范德華力BrI>ICl>Cl2 ,即沸點BrI>ICl>Cl2 ,故答案為:BrI>ICl>Cl2 ;
(3)因F的電負性最大,則HF分子中存在氫鍵則形成二聚分子,故答案為:HF分子間形成氫鍵;
(4)因I3+可看成II2+,孤電子對數由$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(7-1-2×1)=2,σ鍵數為2,則I3+的空間構型為V形,故答案為:V形;
(5)RbICl2加熱時會分解為晶格能相對較大的鹵化物A和鹵素互化物或鹵素單質,氯離子的半徑小于碘離子的半徑,則RbCl的離子鍵長小于RbI的離子鍵長,則RbCl的晶格能較大,則A為RbCl,故答案為:RbCl;
(6)因非金屬性Cl>Br>I,非金屬性越強,則對應的最高價氧化物的酸性越強,則①的酸性最強,在②③中都是碘元素的含氧酸,非羥基氧個數越多,酸性越強,則酸性到為②>③,故答案為:①②③.
點評 本題以鹵素化學為信息來考查原子結構及物質的性質,明確沸點的比較方法、氫鍵對物質性質的影響、非金屬性的比較、孤電子對數的確定是解答的關鍵,本題中(4)是解答的難點.


 培優三好生系列答案
培優三好生系列答案 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:多選題
| A. | A的相對分子質量比B的大16 | |
| B. | 該酯分子結構中一定存在雙鍵 | |
| C. | B的相對分子質量比A大14 | |
| D. | 酯、A、B 3種分子中都含有一種相對分子質量大于60的相同基團 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
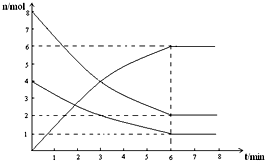 在673K、容積為2L的容器中發生下述反應,2SO2+O2?2SO3,開始時充入8molSO2和4molO2.測得各物質的物質的量隨時間的變化曲線如圖所示:
在673K、容積為2L的容器中發生下述反應,2SO2+O2?2SO3,開始時充入8molSO2和4molO2.測得各物質的物質的量隨時間的變化曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在粗鹽提純中,當加熱到蒸發皿中有較多固體析出,殘留少量液體時,停止加熱,用余熱將液體蒸干 | |
| B. | 當振蕩分液漏斗中的混合溶液時,須用一只手壓住分液漏斗的玻璃塞,另一只手握住旋塞,將分液漏斗倒轉過來,用力振蕩 | |
| C. | 從加碘鹽中獲取碘單質的操作步驟為:溶解-萃取-分液-蒸餾 | |
| D. | 實驗過程中若皮膚不慎沾上少量堿液,應先用大量水沖洗,再用2%醋酸溶液或飽和硼酸溶液洗,最后用水沖洗 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com