
己知N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列結論正確的是( )
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列結論正確的是( )
A. 在密閉容器中加入1mol N2和3mol H2充分反應放熱92.4kJ
B. N2(g)+3H2(g) 2NH3(l)△H=﹣QkJ•mo1﹣1,則Q>92.4
2NH3(l)△H=﹣QkJ•mo1﹣1,則Q>92.4
C. 增大壓強,平衡向右移動,平衡常數增大
D. 若一定條件下反應達到平衡,N2的轉化率為20%,則H2的轉化率為60%
科目:高中化學 來源:2015-2016學年天津一中高一下期末化學試卷(解析版) 題型:選擇題
一定溫度下,在一定容積的密閉容器中加入 NH3 和 O2 各 1mol,發生反應: 4NH3(g)+ 5O2(g)  4NO(g) +6H2O(g)。 下列說法中,表明該反應達到化學平衡狀態的是
4NO(g) +6H2O(g)。 下列說法中,表明該反應達到化學平衡狀態的是
A.氣體的密度不再變化
B.NH3 和 NO 的反應速率相等
C.反應速率不再變化
D.NO 和 H2O 濃度比不再變化
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津靜海一中等校高一下期末化學試卷(解析版) 題型:選擇題
用NA表示阿伏伽德羅常數。下列說法正確的是
A.標準狀況下,7.8g苯中含有的碳碳雙鍵數是0.3NA
B.標準狀況下,11.2L四氯甲烷所含分子數為0.5NA
C.常溫常壓下,14g乙烯分子中含有的碳碳鍵數目為2NA
D.1mol甲基(-CH3)所含電子數為9NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:選擇題
一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示。已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列說法正確的是( )

A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a 點可表示MnCO3的飽和溶液,且c(Mn2+)=c(CO32﹣)
C. b 點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32﹣)
D. c 點可表示MgCO3的不飽和溶液,且c(Mg2+)>c(CO32﹣)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:選擇題
鎳氫電池(NiMH)目前已經成為混合動力汽車的一種主要電池類型。NiMH中的M表示儲氫金屬或合金。該電池在充電過程中的總反應方程式是:Ni(OH)2 + M === NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-==6 Ni(OH)2 + NO2-
下列說法正確的是( )
A.充電過程中OH- 離子從陽極向陰極遷移
B.充電過程中陰極的電極反應式:H2O + M + e-=MH + OH-,H2O中的H被M還原
C. 電池放電過程中,正極電極反應式為:NiOOH + H2O + e-= Ni(OH)2 + OH-
D.NiMH電池中可以用KOH溶液、氨水等作為電解質溶液
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:選擇題
下列實驗中,所采取的分離方法與對應原理都正確的是( )
選項 | 目的 | 分離方法 | 原理 |
A | 分離溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度較大 |
B | 分離乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固體中混雜的NaCl | 重結晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸餾 | 丁醇與乙醚的沸點相差較大 |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省松原市高一下期末化學試卷(解析版) 題型:推斷題
下表為元素周期表的一部分。
碳 | Y | Z |
|
X |
| 硫 | W |
回答下列問題
(1)W元素在周期表中的位置為__________。
(2)表中元素原子半徑最大的是(寫元素符號)__________。
(3)寫出由上表中兩種元素組成,可用作制冷劑的一種化合物的電子式__________。
(4)下列事實不能說明Z元素的非金屬性比S元素的非金屬性強的是__________;
A.Z單質與H2S溶液反應,溶液變渾濁
B.在氧化還原反應中,1molY單質比1molS得電子多
C.Z和S兩元素的簡單氫化物受熱分解,前者的分解溫度高
(5)X與W兩元素的單質反應生成1molX的最高價化合物,恢復至室溫,放熱687kJ,已知該化合物的熔、沸點分別為-69℃和58℃,寫出該反應的熱化學方程式____________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省松原市高一下期末化學試卷(解析版) 題型:選擇題
由反應物X分別轉化為Y和Z的能量變化如圖所示。下列說法正確的是

A.由 反應的ΔH=E5?E2
反應的ΔH=E5?E2
B.由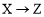 反應的ΔH>0
反應的ΔH>0
C.增大壓強有利于提高Y的產率
D.降低溫度有利于提高Z的產率
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江大慶鐵人中學高二下期末化學試卷(解析版) 題型:實驗題
某同學通過以下裝置測定M 樣品(只含Fe、Al、Cu)中各成分的質量分數。取兩份質 量均為m g 的M 樣品,按實驗1(如圖1)和實驗2(如圖2)進行實驗,該同學順利完成了實驗并測得氣體體積分別為V1 mL 和V2 mL(已折算到標準狀況下)。
量均為m g 的M 樣品,按實驗1(如圖1)和實驗2(如圖2)進行實驗,該同學順利完成了實驗并測得氣體體積分別為V1 mL 和V2 mL(已折算到標準狀況下)。
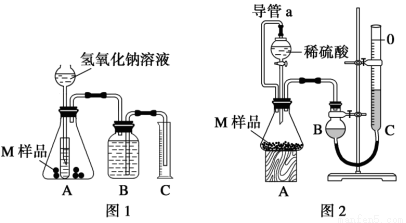
(1)實驗1 裝置中小試管的作用是_______________。
(2)對于實驗2,平視讀數前應依次進行的兩種操作是:
①______________;②________________________。
(3)實驗1 進行實驗前,B 瓶中水沒有裝滿,使測得氣體體積_____ (填“偏大”、“偏小”或“無影響”,下同);若拆去實驗2 中導管a,使測得氣體體積_____________。
(4)該實驗需要0.50 mol·L-1 的NaOH 溶液470 mL,請回答下列問題
①配制時應稱量______g NaOH,配制過程所需儀器____________ (填儀器名稱)。
②配制NaOH 溶液時,NaOH 固體中含有Na2O 雜質會導致所配溶液濃度________。(填“偏大”、“偏小”或“無影響”)。
(5)該實驗中所用稀硫酸是用98%的濃硫酸(ρ =1.84g/cm3)配制的,若將該濃硫酸與等質量的水混合,則所得溶液中溶質物質的量濃度_________9.2mol/L(填>、<、=)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com