
 某溫度時,在2L密閉容器中氣態物質X和Y反應生成氣態物質Z,它們的物質的量隨時間的變化如表所示.
某溫度時,在2L密閉容器中氣態物質X和Y反應生成氣態物質Z,它們的物質的量隨時間的變化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
分析 (1)由表中數據可知,X、Y為反應物,Z為生成物,1min時△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,9min后各物質的物質的量不再變化,且反應物不為0,
(2)根據物質的量的變化得出反應物和生成物,再根據物質的量變化量之比等于化學計量數之比,得到化學方程式;
(3)依據化學反應速率=$\frac{△c}{△t}$,結合圖表數據計算;
(4)根據轉化率等于變化量和初始量的比值計算反應物X的轉化率;
(5)相同條件下氣體的體積之比等于物質的量之比,根據平衡時各組分的濃度計算Z的體積分數.
解答 解:(1)由表中數據可知,X、Y為反應物,Z為生成物,1min時△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,所以X、Y、Z在相同時間內的變化量之比為1:2:2,9min后各物質的物質的量不再變化,平衡時X、Y、Z的物質的量分別為:0.55mol、0.1mol、0.9mol.
橫坐標為時間,從坐標為X、Z的物質的量(n),根據表中數據可畫出曲線為: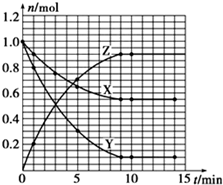 ,
,
故答案為: ;
;
(2)由表中數據看出反應從開始到平衡,X的物質的量減小,應為反應物,0~1min物質的量變化值為1.00mol-0.90mol=0.10mol,Y的物質的量減小,應為反應物,0~1min物質的量變化值為1.00mol-0.80mol=0.20mol,Z的物質的量增多,應為是生成物,物質的量的變化值為0.20mol,9min后各物質的物質的量不再變化,且反應物不為0,故為可逆反應,根據物質的量的變化與化學計量數呈正比,則n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反應方程式為:X(g)+2Y(g)?2Z(g),
故答案為:X(g)+2Y(g)?2Z(g);
(3)0-3min內Z的物質的量變化為0.5mol,則反應在0~3min時間內v(Z)=$\frac{\frac{0.5mol}{2L}}{3min}$=0.083mol/(L•min),
故答案為:0.083mol/(L•min);
(4)平衡時X的物質的量為0.90mol,X的初始物質的量為1.0mol,則該反應達到平衡時反應物X的轉化率為:$\frac{1.0mol-0.55mol}{1.0mol}$×100%=45%,
故答案為:45%;
(5)平衡時Z的物質的量為0.55mol,氣體總物質的量為:0.55mol+0.10mol+0.90mol=1.55mol,
相同條件下氣體體積分數等于物質的量分數,則平衡時Z的體積分數為:$\frac{0.55mol}{1.55mol}$×100%≈58%,
故答案為:58%.
點評 本題考查了化學平衡的計算,題目難度中等,明確化學平衡的特征為解答關鍵,注意掌握化學反應速率、轉化率、體積分數的概念及表達式,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
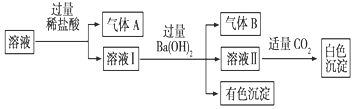 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干種離子,且存在的各離子具有相同的物質的量,某同學對該溶液進行如圖實驗,下列判斷正確的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干種離子,且存在的各離子具有相同的物質的量,某同學對該溶液進行如圖實驗,下列判斷正確的是( )| A. | 氣體A一定是CO2,氣體B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常數K | 10 | 9 | 1 | 0.6 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 容器 | 起始時物質的量 mol | 平衡時物質的量/mol | 平衡常數(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒溫 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒溫 | 2 | 3 | m | K2 |
| 3 | 絕熱 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
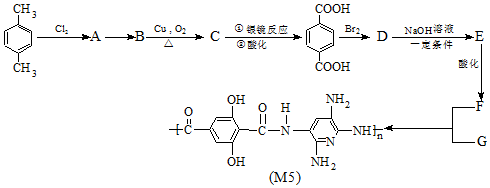
 可與甲醇充分反應,反應后有機產物的名稱為:對苯二甲酸二甲酯
可與甲醇充分反應,反應后有機產物的名稱為:對苯二甲酸二甲酯 .
. ,
,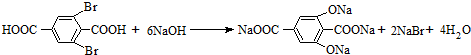 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
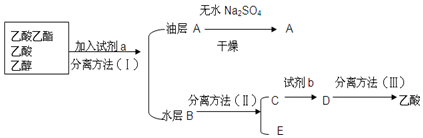
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com