
分析 (1)碳酸的第一、二級電離方程式為H2CO3?H++HCO3-,HCO3-?H++CO32-,電離平衡常數為生成物濃度冪之比與反應物濃度冪之積的比值;
(2)弱酸的電離平衡常數越大,其酸性越強,相同物質的量濃度時電離出來的氫離子濃度越大,水電離出來的氫離子濃度越小;
(3)用pH試紙測溶液pH時,把一小塊pH試紙放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒點在試紙的中部,試紙變色后與標準比色卡比較,確定溶液的pH;據氫硫酸以第一步電離為主,c(HS-)=c(H+)=10-4,依此計算0.1mol/L的氫硫酸的電離度;加水稀釋,促進氫硫酸電離平衡正向移動,n(H2S)減小,氫離子物質的量增大,但濃度減小,據此分析;
(4)據弱酸的電離平衡常數判斷酸性強弱,根據強酸制弱酸判斷離子方程式正誤.
解答 解:(1)碳酸的第一、二級電離方程式為H2CO3?H++HCO3-,HCO3-?H++CO32-,電離平衡常數為生成物濃度冪之比與反應物濃度冪之積的比值,則K2=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,
故答案為:$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$;
(2)上述5種酸中,H2SO3的電離平衡常數最大,其酸性最強,所以相同物質量濃度、相同體積的上述五種酸溶液中,氫離子濃度最大的為H2SO3,HClO的電離平衡常數最小,酸性最弱,酸電離出來的氫離子濃度最小,對水的電離抑制作用最小,水電離出來的氫離子濃度最大,
故答案為:H2SO3;HClO;
(3)用pH試紙測溶液pH時,把一小塊pH試紙放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒點在試紙的中部,試紙變色后與標準比色卡比較,確定溶液的pH;氫硫酸以第一步電離為主,c(HS-)=c(H+)=10-4,其電離度=$\frac{1{0}^{-4}}{0.1}$×100%=0.1%;
A.加水稀釋飽和氫硫酸溶液,促進電離,由于溶液的體積增大的快,所以c(HS-)減小,故A錯誤;
B.加水稀釋飽和氫硫酸溶液,促進電離,由于溶液的體積增大的快,所以c(H+)減小,由于c(H+)×c(OH-)不變,所以c(OH-)增大,故B正確;
C.c(H+)•c(OH-)只與溫度有關,故C錯誤;
D.加水稀釋飽和氫硫酸溶液,c(H+)•c(OH-)不變,由于體積增大,所以n(H+)•n(OH-)增大,故D正確
E.加水稀釋飽和氫硫酸溶液,促進電離,n(H2S)減小,n(HS-)增大,所以$\frac{c(H{S}^{-})}{c({H}_{2}S)}$增大,故E正確;
故答案為:把一小塊試紙放在玻璃片上,用干燥潔凈的玻璃棒沾取待測溶液,點在試紙上,對比標準比色卡,觀察顏色的變化,讀取pH值;0.1%;BDE;
(4)A、HClO的酸性比碳酸若比碳酸氫根離子強,所以少量CO2通入次氯酸鈉溶液中:CO2+H2O+ClO-═HCO3-+HClO是正確的,故A正確;
B.次氯酸具有強氧化性能夠氧化亞硫酸根離子,故B錯誤;
C.亞硫酸的酸性比碳酸強,所以過量SO2通入碳酸鈉溶液中:2SO2+H2O+CO32-═2HSO3-+CO2是正確的,故C正確;
D.醋酸的酸性比碳酸強,過量CH3COOH加入碳酸鈉溶液中應生成二氧化碳和水,故D錯誤;
故答案為:AC.
點評 本題考查了弱電解質的電離、電離常數等,試題知識點較多、綜合性較強,難度中等,充分考查學生的分析能力及靈活應用能力,注意明確溶液酸堿性與溶液pH的關系及計算方法,注意明確電離平衡常數的應用方法.


科目:高中化學 來源:2016-2017學年西藏拉薩中學高二上第一次月考化學試卷(解析版) 題型:選擇題
下列說法中正確的是
A.同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃的條件下△H不相同
B.化學反應中的能量變化都表現為熱量變化
C.任何放熱反應在常溫下都能發生
D.化學反應的反應熱可通過反應物的鍵能之和減去生成物的鍵能之和求得
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上9月調研化學試卷(解析版) 題型:選擇題
將下列溶液與1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
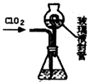 二氧化氯(C1O2)是目前國際上公認的第四代高效、無毒的消毒劑,是一種黃綠色的氣體,易溶于水.實驗室可用Fa-14Cl、鹽酸、NaCl02(亞氯酸鈉)為原料制備C1O2的流程如下:
二氧化氯(C1O2)是目前國際上公認的第四代高效、無毒的消毒劑,是一種黃綠色的氣體,易溶于水.實驗室可用Fa-14Cl、鹽酸、NaCl02(亞氯酸鈉)為原料制備C1O2的流程如下: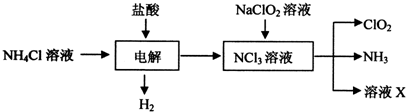
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中導電粒子的數目減少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$減小 | |
| C. | 醋酸的電離程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 常溫下,將某一元酸HA和NaOH溶液等體積混合,兩種溶液的濃度和混合后所得溶液的pH如表:
常溫下,將某一元酸HA和NaOH溶液等體積混合,兩種溶液的濃度和混合后所得溶液的pH如表:| 實驗編號 | HA物質的量濃度 (mol•L-1) | NaOH物質的量濃度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
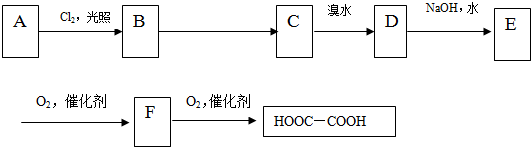
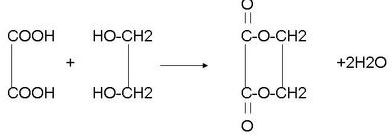 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com