
| 開始沉淀時的pH | 沉淀完全時的pH | |
| Mg2+ | 9.6 | 11.0 |
| Fe3+ | 2.7 | 3.7 |

| 實驗 編號 | 待測溶液的體積(mL) | 滴定前標液的 體積讀數(mL) | 滴定后標液的 體積讀數(mL) |
| 1 | 20.00 | 1.20 | 21.22 |
| 2 | 20.00 | 2.21 | 22.19 |
| 3 | 20.00 | 1.50 | 23.48 |
分析 (1)根據流程圖可知,工業廢水(主要含Mg2+、Fe3+、Cl-)加入試劑①后得氯化鎂溶液和沉淀,沉淀經過一系列的變化得到鐵,說明沉淀中有鐵元素,所以試劑①的作用是使鐵離子沉淀,而不使鎂離子沉淀,據此判斷;
(2)由于鎂離子易水解,所以從氯化鎂晶體中獲得無水氯化鎂要在氯化氫氣流中進行,根據裝置圖可知,裝置A就是用來制備氯化氫氣體;
(3)①用高錳酸鉀溶液滴定亞鐵離子,由于在反應中高錳酸鉀溶液的顏色會發生變化,所以不用指示劑;
②A.錐形瓶水洗后,用待測液潤洗過再裝待測液,則錐形瓶中待測液偏多;
B.滴定前讀數仰視,滴定后讀數俯視,則讀出的標準液的體積偏小;
C.滴定管水洗后,未用標準液洗滌,則標準液被稀釋,所用標準液體積偏大;
D.滴定管裝液后尖嘴部位有氣泡,滴定后氣泡消失,則讀出的標準液的體積偏大,據此分析;
③根據表中提供的數據可知,實驗3的數據與前面兩組數據偏差較大,為偶然誤差,應舍去,所以在實驗中用去的高錳酸鉀溶液的體積為$\frac{20.02+19.98}{2}$mL=20.0mL,則高錳酸鉀的物質的量為1.000×10-2mol•L-1×0.02L=2.000×10-4mol,根據5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知亞鐵離子的物質的量為1.000×10-3mol,所以5.000g廢水中亞鐵離子的物質的量為$\frac{100ml}{25.00ml}$×1.000×10-3mol=4.000×10-3mol,其質量為0.224g,根據$\frac{鐵元素的質量}{樣品的質量}$×100%計算鐵元素的質量分數.
解答 解:(1)根據流程圖可知,工業廢水(主要含Mg2+、Fe3+、Cl-)加入試劑①后得氯化鎂溶液和沉淀,沉淀經過一系列的變化得到鐵,說明沉淀中有鐵元素,所以試劑①的作用是使鐵離子沉淀,而不使鎂離子沉淀,即①的作用是使溶液的pH升高,使Fe3+轉化為氫氧化鐵沉淀而分離出去,可用MgCO3或Mg(OH)2,故選AB,
故答案為:AB;使溶液的pH升高,使Fe3+轉化為氫氧化鐵沉淀而分離出去;
(2)由于鎂離子易水解,所以從氯化鎂晶體中獲得無水氯化鎂要在氯化氫氣流中進行,根據裝置圖可知,裝置A就是用來制備氯化氫氣體,
故答案為:制備干燥的HCl氣體,抑制MgCl2的水解;
(3)①用高錳酸鉀溶液滴定亞鐵離子,由于在反應中高錳酸鉀溶液的顏色會發生變化,自身可作指示劑,所以不用指示劑,
故答案為:否;KMnO4溶液自身可作指示劑;
②A.錐形瓶水洗后,用待測液潤洗過再裝待測液,則錐形瓶中待測液偏多,會使測量結果偏大;
B.滴定前讀數仰視,滴定后讀數俯視,則讀出的標準液的體積偏小,會使測量結果偏小;
C.滴定管水洗后,未用標準液洗滌,則標準液被稀釋,所用標準液體積偏大,會使測量結果偏大;
D.滴定管裝液后尖嘴部位有氣泡,滴定后氣泡消失,則讀出的標準液的體積偏大,會使測量結果偏大,
故選 ACD;
③根據表中提供的數據可知,實驗3的數據與前面兩組數據偏差較大,為偶然誤差,應舍去,所以在實驗中用去的高錳酸鉀溶液的體積為$\frac{20.02+19.98}{2}$mL=20.0mL,則高錳酸鉀的物質的量為1.000×10-2mol•L-1×0.02L=2.000×10-4mol,根據5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知亞鐵離子的物質的量為1.000×10-3mol,所以5.000g廢水中亞鐵離子的物質的量為$\frac{100ml}{25.00ml}$×1.000×10-3mol=4.000×10-3mol,其質量為0.224g,所以鐵元素的質量分數=$\frac{鐵元素的質量}{樣品的質量}$×100%=$\frac{0.224}{5.000}$×100%=4.480%,
故答案為:4.480%.
點評 本題主要考查了工業生產來提取鎂的流程,側重考查混合物分離提純,把握流程中的分離方法為解答的關鍵,注意氯化鎂的性質和制鎂的方法,題目難度中等.


 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源: 題型:選擇題
| A. | 有機物 CH4 和CH3OH,不論以何種比例混合,混合物完全燃燒后,產生的水和二氧化碳的分子數比為2:1 | |
| B. | 為了除去甲烷中含有的少量乙烯氣體,將混合氣體通過酸性高錳酸鉀溶液中洗氣,可以得到純凈的甲烷氣體 | |
| C. | 將a g CH2O、H2以及CO的混合氣體在氧氣中完全燃燒的產物,通過足量的過氧化鈉固體,充分反應后,固體增重也是a g | |
| D. | 實驗室制取乙炔時,可將生成的氣體通過硫酸銅溶液,除去可能存在的H2S等氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
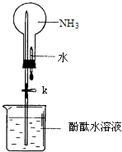 某學習小組欲制取氨氣并探究其性質.請回答:
某學習小組欲制取氨氣并探究其性質.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定溫度下,l L 0.50 mol/LNH4C1溶液與2 L0.25mol/LNH4C1溶液NH4+的離子數均為0.5NA | |
| B. | 氫氧燃料電池正極消耗22.4 L(標準狀況)氣體時,電路中通過的電子數目為2NA | |
| C. | 在電解精煉粗銅的過程中,當陰極析出32 g銅時轉移電子數為NA | |
| D. | pH=5的NaHSO4溶液中水電離出的氫離子數目為10-5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 解釋或結論 |
| A | 在新生成的AgCl沉淀中滴入稀KI溶液,振蕩 | 白色沉淀轉化為黃色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向裝有Fe(NO3)2溶液的試管中加入稀H2SO4, | 在管口觀察到紅棕色氣體 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加熱 | 有淺黃色沉淀生成 | CH3CH2X中含有Br- |
| D | 向淀粉溶液中加入稀H2SO4,加熱幾分鐘,冷卻后再加入新制Cu(OH)2濁液,加熱, | 沒有紅色沉淀生成 | 淀粉沒有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com