
【題目】汽車劇烈碰撞時,安全氣囊中發生反應 10NaN3+2KNO3 =K2O+5X+16N2↑,下列說 法不正確的是( )
A.X 的化學式為 Na2O
B.上述反應中 NaN3 被氧化,KNO3 發生還原反應
C.每生成 1.6molN2,則轉移的電子為 3 mol
D.若被氧化的 N 原子的物質的量為 3mol,則氧化產物比還原產物多 1.4 mol
【答案】C
【解析】
A.根據原子守恒可知,生成物中缺少10個Na,5個O,而X粒子有5個,所以X的化學式為Na2O,故A正確;
B. NaN3 中鈉元素化合價為+1價,氮元素的化合價為-![]() ,發生反應后,氮元素的化合價由-
,發生反應后,氮元素的化合價由-![]() 價升高到0價,NaN3被氧化,發生氧化反應;而KNO3 中+5價氮,降低到0價,發生還原反應,故B正確;
價升高到0價,NaN3被氧化,發生氧化反應;而KNO3 中+5價氮,降低到0價,發生還原反應,故B正確;
C.根據方程式可知,2KNO3→N2,化合價降低10,即2molKNO3參與反應轉移電子物質的量為10mol,生成16molN2,則每生成1.6molN2,則轉移的電子為 1 mol,故C錯誤;
D.根據方程式可知,生成16molN2,轉移電子的物質的量為10mol,被氧化的氮原子有30mol,被還原的N原子有2mol,因此氧化產物(氮氣)比還原產物(氮氣)多(15mol-1mol)=14mol;若被氧化的 N 原子的物質的量為 3mol,則氧化產物比還原產物多 1.4 mol,故D正確;
故答案選C。


科目:高中化學 來源: 題型:
【題目】已知NA為阿伏加德羅常數,下列說法中不正確的是( )
A.常溫常壓下,16gO2和O3的混合氣體中含有N A個原子
B.17克OH-所含電子數目為10NA
C.標準狀況下,11.2L氬氣中含有0.5NA個氦原子
D.1L2mol·L-1的硫酸鎂溶液中含有的氧原子為8NA個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為![]() ,下列關于該物質的說法中不正確的是
,下列關于該物質的說法中不正確的是
A. 該物質不能發生消去反應,但能在一定條件下發生加聚反應
B. 該物質不能和AgNO3溶液反應產生AgBr沉淀
C. 該物質在NaOH的醇溶液中加熱可轉化為醇類
D. 該物質可使溴水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在由Na2S、Na2SO3、Na2SO4組成的固體混合物中,已知S的質量分數為25.6%,則氧的質量分數為
A. 36.8%B. 37.6%C. 51.2%D. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液450mL。根據這兩種溶液的配制情況回答下列問題:
(1)如圖所示的儀器中配制溶液肯定不需要的是_________(填序號),本實驗所用玻璃儀器E的規格和名稱為_____________。

(2)下列操作中,容量瓶所不具備的功能有__________(填序號)
a.配制一定體積準確濃度的標準溶液 b.長期貯存溶液
c.用來加熱溶解固體溶質 d.量取220毫升體積的液
(3)如果實驗室有l0mL、25mL、50mL量筒,根據計算得知:量取質量分數為98%、密度為1.84g.cm-3的濃硫酸應選用__________mL規格的量筒最好。
(4)在配制NaOH溶液實驗中,其他操作均正確,若定容時仰視刻度線,則所配制溶液濃度_______0.1mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷卻即轉移至容量瓶定容,則所配制溶液濃度__________0.1mol/L。
(5)如果定容時不小心超過刻度線,應如何操作__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅、鐵、鋁是重要的金屬材料,銅、鐵、鋁及其化合物有非常重要的用途。
(1)高鐵酸鉀(K2FeO4)是一種高效多功能水處理劑。濕法制備高鐵酸鉀(K2FeO4)的反應體系中有六種微粒:Fe(OH)3、ClO 、OH 、FeO42、Cl 、H2O。
①寫出并配平濕法制高鐵酸鉀的離子反應方程式:________________________________。
②若反應過程中轉移了 0.3mol 電子,則還原產物的物質的量為_______mol。
(2)以鋁土礦(主要成分為Al2O3和Fe2O3、SiO2)為原料制備鋁的一種工藝流程如下:
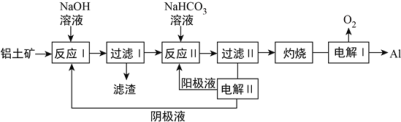
①濾渣主要成分為________。
②在實驗室灼燒操作應選擇的實驗儀器為_________。
③反應II中,加入NaHCO3一段時間才有沉淀生成,寫出加入少量NaHCO3時發生反應的離子方程式____________________________________。
(3)已知25 ℃時Ksp[Cu(OH)2]=2.2×1020,Ksp[Al(OH)3]=1.1×1033。在25 ℃下,向濃度均為0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化學式)。
(4)以含有少量硫酸的硫酸銅溶液為原料制備銅:a g鐵粉與上述溶液完全反應后,得到a g銅,則參與反應的CuSO4與H2SO4的物質的量之比為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型的合成氨的方法如圖所示,下列說法正確的是
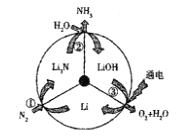
A. 反應①屬于“氮的固定”B. 反應②屬于氧化還原反應
C. 反應③可通過電解![]() 水溶液實現D. 上述三步循環的總結果為:
水溶液實現D. 上述三步循環的總結果為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖實驗裝置用于驗證某些物質的性質。在試管A中裝入足量的固體NaHCO3,D為固定蚊香的硬紙片。試回答下列問題:
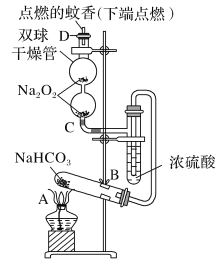
(1)在A試管內發生反應的化學方程式是_____。
(2)B裝置的作用是_____。
(3)在雙球干燥管內發生反應的化學方程式為____。
(4)雙球干燥管內及D處觀察到的實驗現象是_____。
(5)若將干燥管內的Na2O2換成Na2O,則雙球干燥管內及D處觀察到的實驗現象是:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉及其化合物具有廣泛的用途。
(1)常溫下,濃度均為0.1 mol/L的下列五種鈉鹽溶液的pH如表所示:
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述幾種鈉鹽的陰離子,結合氫離子能力最強的是______(填離子符號),根據表中數據,將濃度均為0.01mol/L的下列四種溶液分別稀釋100倍,pH變化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知幾種離子開始沉淀時溶液的pH如下表所示:
離子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
當向含有相同濃度的Cu2+、Mg2+、Fe2+的溶液中滴加氫氧化鈉溶液時,________(填離子符號)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸銅溶液中銅離子沉淀較為完全(使銅離子的濃度降至原來的千分之一),則應向溶液中加入氫氧化鈉溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com