
能源是國民經濟發展的重要基礎,我國目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa時,16 g CH4完全燃燒生成液態水時放出的熱量是890.31 kJ,則CH4燃燒的熱化學方程式是 。
(2)已知:C(s)+ O2(g) CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
H2(g)+ 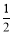 O2(g)
O2(g) H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g)+ 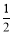 O2(g)
O2(g) CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
則煤的氣化主要反應的熱化學方程式是
C(s)+ H2O(g) CO(g)+ H2(g) ΔH= kJ•mol-1。
CO(g)+ H2(g) ΔH= kJ•mol-1。
 百年學典課時學練測系列答案
百年學典課時學練測系列答案 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案科目:高中化學 來源:2016-2017學年江蘇省無錫江陰市四校高二上期中化學試卷(解析版) 題型:選擇題
按圖示裝置,實驗能夠成功的是

A B C D
A.裝置用于檢驗溴丙烷消去產物 B.裝置用于測定乙醇的結構式
C.裝置用于提取I2的CCl4溶液中的I2 D.裝置用于除去甲烷中的乙烯
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市武清區等五區縣高三上學期期中考試化學試卷(解析版) 題型:實驗題
高純MnCO3是制備高性能磁性材料的主要原料。實驗室以MnO2為原料制備少量高純MnCO3的操作步驟如下:
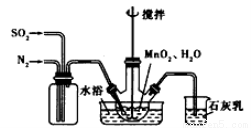
(1)制備MnSO4溶液:在燒瓶中(裝置見上圖)加入一定量MnO2和水,攪拌,通人SO2和N2混合氣體,反應3h。停止通入SO2,繼續反應片刻,過濾。
①寫出反應方程式:MnO2+ H2SO3=_________________;
石灰乳參與反應的化學方程式為___________________。
②反應過程中,為使SO2盡可能轉化完全,在通人SO2和N2比例一定、不改變固液投料的條件下,可采取的合理措施有(填兩種)________________、___________________。
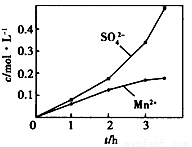
③若實驗中將N2換成空氣,測得反應液中Mn2+、SO42-的濃度隨反應時間t變化如上圖。導致溶液中Mn2+、SO42-的濃度變化產生明顯差異,其中Mn2+對O2與H2SO3反應所起的作用是_________________。
(2)制備高純MnCO3固體:已知MnCO3難溶于水、乙醇,潮濕時易被空氣氧化,100℃開始分解;Mn(OH)2開始沉淀的pH= 7.7。
請補充由(1)制得的MnSO4溶液制備高純MnCO3的操作步驟[實驗中可選用的試劑:H2O 、Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①邊攪拌邊加入_________________,并控制溶液pH_______7.7;
②_______________________;
③_______________________;
④_______________________;
⑤低于100℃干燥。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市武清區等五區縣高三上學期期中考試化學試卷(解析版) 題型:選擇題
常溫下,0.2mol/L的一元酸HA與等濃度的NaOH溶液等體積混合后(假設混合液體積為二者之和),所得溶液中部分微粒組分及濃度如圖所示,下列說法不正確的是
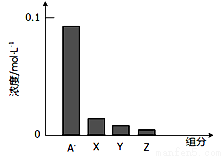
A.HA是弱酸
B.該混合液pH > 7
C.該混合溶液中:c(A-)+c(Y)=c(Na+)
D.圖中x表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年北京五十六中九高三上學期期中考試化學試卷(解析版) 題型:推斷題
乙烯是重要的化工基礎原料。用乙烯合成光學樹脂CR-39單體的過程如下:

已知:i.CR-39單體結構簡式是:
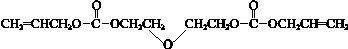
ii.酯與醇有如下反應:

(1)乙烯轉化為A的反應類型是_______,B中官能團名稱是_______。
(2)在D、E的分子中,都只有一種化學環境的氫原子。
①D的結構簡式是_____________________。
②E為五元環狀化合物,E與CH3OH反應的化學方程式是___________________。
(3)G與足量NaOH溶液反應的化學方程式是________________。
(4)F的一種同分異構體K,其分子中不同化學環境的氫原子個數比是3∶1∶1∶1,且能與NaHCO3反應。
①K能發生消去反應,生成的有機物的結構簡式是___________________。
②K在一定條件下合成高分子化合物的化學方程式是_____________________。
(5)下列有關C的敘述正確的是(填寫序號)_______。
a.能與乙酸發生酯化反應
b.能與乙醇發生酯化反應
c.1 mol C最多能與2 mol Na反應
d.C的同分異構體不能發生銀鏡反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年北京五十六中九高三上學期期中考試化學試卷(解析版) 題型:選擇題
已知某強酸性溶液中存在較多的Ba2+、NO3-,則溶液中還可能大量存在的離子組是
A.K+、NH4+、HCO3- B.Na+、Cu2+、Cl-
C.Cu2+、Mg2+、SO42- D.Fe2+、Ca2+、Cl-
查看答案和解析>>
科目:高中化學 來源:2016-2017學年北京五十六中九高三上學期期中考試化學試卷(解析版) 題型:選擇題
下列有關化學實驗的敘述中,不正確的是
A.用飽和食鹽水替代水跟電石作用,可以有效控制產生乙炔的速率
B.重結晶法提純苯甲酸時,為除去雜質和防止苯甲酸析出,應該趁熱過濾
C.制備乙酸乙酯時,為除去乙酸乙酯中的乙酸,用氫氧化鈉溶液收集產物
D.實驗室制取乙烯并驗證其性質時,將產生的氣體通入到NaOH溶液中除去雜質
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣西桂林市高三上學期期中考化學試卷(解析版) 題型:推斷題
甲、乙、丙、丁四種有機化合物,它們的組成中均含碳40%,含氫6.67%,含氧53.33%。甲、乙、丙都能發生銀鏡反應,乙、丙是丁的同分異構體。已知甲在常溫下為氣體,它有如下反應:甲+C6H5OH →X(高分子化合物)。丁在16.6℃以下凝結為冰狀晶體,丁有以下反應:丁+碳酸鈉→ 二氧化碳+Y+水,丙不能發生水解反應,但可發生酯化反應。
(1)甲的結構式為 ;乙的名稱為 ;丁的結構簡式為 。
(2)丙發生銀鏡反應的方程式為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省高一上期中化學卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數的值.下列說法中正確的是
A.5.6 g Fe和足量的氯氣完全反應失去電子數為0.2NA
B.標準狀況下,11.2L CCl4所含的分子數為0.5NA
C.0.5 mol•L﹣1AlCl3溶液中Cl﹣的數目為1.5NA
D.17g氨氣中含有的電子數為10NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com