
【題目】一定溫度下,在2 L的密閉容器中,X、Y、Z三種氣體的量隨時間變化的曲線如圖所示:

(1)從反應開始到10 s時,用Z表示的反應速率為 ,X的物質的量濃度減少了 ,Y的轉化率為 。
(2)該反應的化學方程式為
(3)10 s后的某一時刻(t1)改變了外界條件,其速率隨時間的變化圖像如圖所示:

則下列說法符合該圖像的是 。
A.t1時刻,增大了X的濃度 B.t1時刻,升高了體系溫度
C.t1時刻,縮小了容器體積 D.t1時刻,使用了催化劑
【答案】(1)0.079 mol·L-1·s-1 0.395 mol·L-1 79.0%
(2)X(g)+Y(g)![]() 2Z(g)
2Z(g)
(3)CD
【解析】(1)分析圖像知:
v(Z)= ![]() =0.079 mol·L-1·s-1,
=0.079 mol·L-1·s-1,
Δc(X)= ![]() =0.395 mol·L-1,
=0.395 mol·L-1,
Y的轉化率α(Y)=![]() ×100%=79%。
×100%=79%。
(2)由各物質轉化的量:X為0.79 mol,Y為0.79 mol,Z為1.58 mol可知方程式中各物質的化學計量數之比為1∶1∶2,則化學方程式為X(g)+Y(g)![]() 2Z(g)。
2Z(g)。
(3)由圖像可知,外界條件同等程度地增大了該反應的正、逆反應速率。增大X的濃度、升高體系溫度均不會同等程度地改變正、逆反應速率,A、B錯誤。該反應為反應前后氣體體積不變的反應,縮小容器體積或增大壓強,均可同等程度地增大正、逆反應速率,C正確。D使用催化劑可同等程度地改變正、逆反應速率,D正確。


科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E、F是元素周期表中前36號元素,它們的原子序數依次增大。A的質子數、電子層數、最外層電子數均相等,B元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子總數相同,D的基態原子核外成對電子數是成單電子數的3倍,E4+與氬原子的核外電子排布相同。F是第四周期d區原子序數最大的元素。請回答下列問題:
(1)寫出E的價層電子排布式 。
(2)A、B、C、D電負性由大到小的順序為________________(填元素符號)。
(3)F(BD)4為無色揮發性劇毒液體,熔點-25℃ ,沸點43℃。不溶于水,易溶于乙醇、乙醚、苯等有機溶劑,呈四面體構型,該晶體的類型為 ,F與BD之間的作用力為 。
(4)開發新型儲氫材料是氫能利用的重要研究方向。
①由A、B、E三種元素構成的某種新型儲氫材料的理論結構模型如圖1所示,圖中虛線框內B原子的雜化軌道類型有 種;
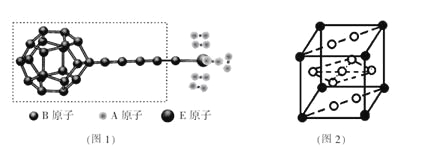
②分子X可以通過氫鍵形成“籠狀結構”而成為潛在的儲氫材料。X一定不是 (填標號);
A.H20 B. CH4C.HF D.CO(NH2)2
③F元素與鑭( La)元素的合金可做儲氫材料,該晶體的晶胞如圖2所示,晶胞中心有一個F原子,其他F原子都在晶胞面上,則該晶體的化學式為 ;已知其摩爾質量為Mg.mol-1,晶胞參數為apm,用NA表示阿伏伽德羅常數,則該晶胞的密度為 g.cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 化學反應除了生成新的物質外,還伴隨著能量的變化
B. 據能量守恒定律,反應物的總能量一定等于生成物的總能量
C. 放熱反應不需要加熱就能發生
D. 吸熱反應不加熱就不會發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反應。設計如圖裝置(C1、C2均為石墨電極),分別進行下述操作。
AsO33-+I2+H2O是可逆反應。設計如圖裝置(C1、C2均為石墨電極),分別進行下述操作。
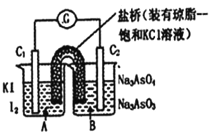
Ⅰ.向B燒杯中逐滴加入濃鹽酸
Ⅱ.向B燒杯中逐滴加入40% NaOH溶液
結果發現電流計指針均發生偏轉.據此,下列判斷正確的是
A.Ⅰ操作過程中,C2棒上發生的反應為:AsO43-+2H++2e-=AsO33-+H2O
B.操作Ⅱ過程中,鹽橋中的K+移向B燒杯溶液
C.操作Ⅰ過程中,C1為正極
D.Ⅱ操作過程中,C1棒上發生的反應為:2I-_2e-=I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將0.15mol的MnO2與過量的12mol/L的濃鹽酸反應,與50mL12mol/L的濃鹽酸與過量MnO2反應,兩者產生的氯氣相比(其它反應條件相同)( )
A.一樣多
B.后者較前者多
C.前者較后者多
D.無法比較
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有如下儀器,儀器中已注入溶液,回答下列問題。
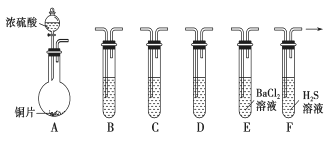
(1)加熱裝置A,寫出銅與濃硫酸反應的化學方程式:_______________________________
(2)驗證碳、硅非金屬性的相對強弱(已知酸性:H2SO3>H2CO3),若選擇儀器A、B、C、D并相連接,則B、C、D中所選擇的試劑為B________、C________、D________。能說明碳的非金屬性比硅強的實驗現象是_________________。
(3)驗證SO2的氧化性、還原性。若選擇A、E、F儀器,并按A、E、F順序連接。
①則證明SO2有氧化性的實驗現象是________________,反應方程式為________________。
②若證明SO2具有還原性,在E中采取的實驗操作為_________________________________,
其實驗現象為__________________,反應原理為__________________(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的兩塊鈉,第一塊在足量氧氣中加熱,第二塊在足量氧氣(常溫)中充分反應,則下列說法正確的是( )
A. 第一塊鈉失去電子多 B. 兩塊鈉的反應產物質量一樣大
C. 第二塊鈉的反應產物質量大 D. 兩塊鈉失去電子一樣多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備硫酸常用接觸法,工業上制硝酸常用氨的催化氧化法。下列關于工業上制硫酸與硝酸的說法中不正確的是( )
A. 在沸騰爐中進行的反應為:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 工業上制硫酸與硝酸都用到同一工藝設備:吸收塔
C. 硫酸工業、硝酸工業都需要對工業尾氣進行處理
D. 工業上制備硫酸和制硝酸涉及的反應都屬于氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com