
【題目】(1)過渡金屬元素鐵能形成多種配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合鐵(Ⅲ)]和Fe(CO)x等.
①基態Fe3+的M層電子排布式為 .
②配合物Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x= . Fe(CO)x常溫下呈液態,熔點為﹣20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷Fe(CO)x晶體屬于 (填晶體類型);
(2)O和Na形成的一種只含有離子鍵的離子化合物的晶胞結構如圖,距一個陰離子周圍最近的所有陽離子為頂點構成的幾何體為 . 已知該晶胞的密度為ρ g/cm3 , 阿伏加德羅常數為NA , 求晶胞邊長a= cm.(用含ρ、NA的計算式表示)
(3)下列有關的說法正確的是 .
A.第一電離能大小:S>P>Si
B.電負性順序:C<N<O<F
C.因為晶格能CaO比KCl高,所以KCl比CaO熔點低
D.SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大
E.分子晶體中,共價鍵鍵能越大,該分子晶體的熔沸點越高
(4)原子序數小于36的X、Y、Z、W四種元素,其中X是形成化合物種類最多的元素,Y原子基態時最外層電子數是其內層電子數的2倍,Z原子基態時2p原子軌道上有3個未成對的電子,W的原子序數為29.回答下列問題:
①Y2X2分子中Y原子軌道的雜化類型為 , 1mol Y2X2含有σ鍵的數目為
②化合物ZX3的沸點比化合物YX4的高,其主要原因是 .
③元素Y的一種氧化物與元素Z的一種氧化物互為等電子體,元素Z的這種氧化物的分子式是 .
【答案】3s23p63d5;5;分子晶體;立方體;![]() ?;BC;sp雜化;3 NA或3×6.02×1023個;NH3分子存在氫鍵;N2O
?;BC;sp雜化;3 NA或3×6.02×1023個;NH3分子存在氫鍵;N2O
【解析】(1)①Fe原子核外有26個電子,核外電子排布為1s22s22p63s23p63d64s2 , Fe原子失去4s能級2個電子、3d能級1個電子形成Fe3+ , Fe3+電子排布式為1s22s22p63s23p63d5 , 則M層電子排布式為:3s23p63d5 ,
所以答案是:3s23p63d5;
②配合物Fe(CO)x的中心原子是鐵原子,其價電子數是8,每個配體提供的電子數是2,8+2x=18,x=5,分子晶體的熔沸點較低,根據題給信息知,該物質的熔沸點較低,所以為分子晶體,
所以答案是:5;分子晶體;
(2)距一個陰離子周圍最近的所有陽離子為頂點構成的幾何體是立方體,該晶胞中鈉離子個數是8,氧離子個數=8×![]()
![]() =4,V=
=4,V=![]() =
=![]() =
=![]() cm3 , 則a=
cm3 , 則a=![]() cm,
cm,
所以答案是:立方體;![]() ;
;
(3)A.同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第VA族元素的第一電離能大于相鄰元素,所以第一電離能大小:P>S>Si,故A錯誤;
B.同一周期元素中,元素的電負性隨著原子序數的增大而增大,所以電負性順序:C<N<O<F,故B正確;
C.晶格能與離子晶體的熔點成正比,離子半徑與晶格能成反比,離子所帶電荷與晶格能成正比,鈣離子電荷大于鉀離子,且鈣離子半徑小于鉀離子,氯離子所帶電荷小于氧離子,且氯離子半徑大于氧離子,所以氯化鉀的晶格能小于氧化鈣,則氯化鉀的熔點比氧化鈣低,故C正確;
D.二氧化硫分子中硫原子的價層電子對是3且含有一個電子對,所以二氧化硫是V形結構,為極性分子,二氧化碳是非極性分子,根據相似相溶原理知,二氧化硫易溶于水,故D錯誤;
E.分子晶體中,物質的熔沸點與其相對分子質量成正比,故D錯誤;
所以答案是:BC;
(4)原子序數小于36的X、Y、Z、W四種元素,其中X是形成化合物種類最多的元素,則X是H元素;
Y原子基態時最外層電子數是其內層電子數的2倍,最外層電子數不超過8,所以內層電子數只能是2,則Y是C元素;
Z原子基態時2p原子軌道上有3個未成對的電子,則Z是N元素,W的原子序數為29,則W是Cu元素.
①Y2X2是乙炔,分子式為C2H2 , 碳氫原子之間存在σ鍵,碳碳三鍵中含有一個σ鍵,所以每個碳原子含有2個σ鍵,采取sp雜化,一個乙炔分子中含有3個σ鍵,所以1mol Y2X2含有σ鍵3mol,即為3 NA或3×6.02×1023個,
所以答案是:sp雜化;3 NA或3×6.02×1023個;
②N原子電負性較大,C原子電負性較小,所以氨氣分子中存在氫鍵,甲烷分子中不含氫鍵,氫鍵的存在導致氨氣的沸點大于甲烷,
所以答案是:NH3分子存在氫鍵;
③CO2和N2O的原子個數相等、價電子數相等,所以是等電子體,所以答案是:N2O.
【考點精析】解答此題的關鍵在于理解晶體的類型與物質熔點、硬度、導電性等的關系的相關知識,掌握不同晶體類型的物質:原子晶體>離子晶體>分子晶體;同種晶體類型的物質:晶體內微粒間的作用力越大,溶、沸點越高.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】目前世界上60%的鎂是從海水中提取的。已知海水提取鎂的主要步驟如下:

(1)關于加入試劑①作沉淀劑,有以下幾種不同方法,請完成下列問題。
方法 | 是否正確 | 簡述理由 |
方法1:直接往海水中加入沉淀劑 | 不正確 | (一) |
方法2:高溫加熱蒸發海水后,再加入沉淀劑 | (二) | (三) |
你認為最合理的其他方法是: (四) | ||
(一)__________________________________________________;
(二)__________________________________________________;
(三)__________________________________________________;
(四)__________________________________________________。
(2)框圖中加入的試劑①應該是________(填化學式);加入的試劑②是________(填化學式);工業上由無水MgCl2制取鎂的化學方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2![]() 2NO+O2在密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2在密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n mol O2的同時生成2n mol NO2
②單位時間內生成n mol O2的同時生成2n mol NO
③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2∶2∶1的狀態
④混合氣體的顏色不再改變的狀態
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】太陽能電池板材料除單晶硅外,還有銅、銦、鎵、硒等化學物質.
(1)基態硅原子的電子排布式
(2)有一類組成最簡單的有機硅化合物叫硅烷.硅烷的組成、結構與相應的烷烴相似.硅烷中硅采取 雜化方式,硅烷的沸點與相對分子質量的關系如圖所示,呈現這種變化的原因是 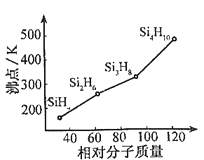
(3)硒和硫同為VIA族元素,與其相鄰的元素有砷和溴,則三種元素的電負性由小到大的順序為 .(用元素符號表示)
(4)氣態SeO3分子的立體構型為 ,與SeO3互為等電子體的一種離子為 (填化學式).
(5)一種銅金合金晶體具有面心立方最密堆積結構,在晶胞中金原子位于頂點,銅原子位于面心,則該合金中金原子(Au)與銅原子(Cu)個數比為 ;若該晶體的晶胞棱長為a pm,則該合金密度為 g/cm3 . (列出計算式,不要求計算結果,阿伏伽德羅常數的值為NA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下圖點滴板上進行四個溶液間反應的小實驗,其對應反應的離子方程式書寫正確的是( )
A.a反應:Fe2++2H++H2O2=Fe3++2H2O
B.b反應:HCO3-+OH-=CO32-+H2O
C.c反應:H++OH-=H2O
D.d反應:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、R、W均為周期表中前四周期的元素,其原子序數依次增大;X2﹣和Y+有相同的核外電子排布;Z的氫化物的沸點比其上一周期同族元素氫化物的沸點低;R的基態原子在前四周期元素的基態原子中單電子數最多;W為金屬元素,X與W形成的某種化合物與Z的氫化物的濃溶液加熱時反應可用于實驗室制取Z的氣態單質.回答下列問題(相關回答均用元素符號表示):
(1)R的基態原子的核外電子排布式是 .
(2)Z的氫化物的沸點比其上一周期同族元素氫化物的沸點低的原因是 .
(3)X與Z中電負性較大的是 . Z的某種含氧酸鹽常用于實驗室中X的單質的制取,此酸根離子的空間構型是 , 此離子中含有的化學鍵類型是 , X﹣Z﹣X的鍵角109.5°.(填“>”“=”或“<”)(提示:孤電子對之間的斥力>孤電子對與成鍵電子對之間的斥力>成鍵電子對之間的斥力).
(4)X與Y形成的化合物Y2X的晶胞如圖.其中X離子的配位數為 , 以相距一個X離子最近的所有Y離子為頂點構成的幾何體為 . 該化合物與MgO相比,熔點較高的是 . 
(5)已知該化合物的晶胞邊長為a pm,則該化合物的密度為gcm﹣3 . (只要求列算式,不必計算出數值,阿伏加德羅常數的數值為NA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按化學反應中元素化合價是否發生變化,無機反應可以分為氧化還原反應和非氧化還原反應.這種分類方法與將無機反應按反應形式的不同分為四種基本反應類型是完全不同的分類方式,這二者的關系如圖.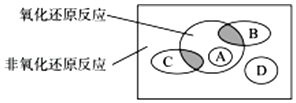
圖中方框內區域表示所有的化學反應,大圓內區域表示氧化還原反應,大圓外區域表示非氧化還原反應,其中A~D分別表示四種基本反應類型.請分別填出:
(1)化學反應可以分為哪四種基本反應類型:、、、 .
(2)若圖中B圈表示化合反應,則:
B圈與氧化還原反應重疊的陰影部分表示哪一類反應?;
C圈與氧化還原反應重疊的陰影部分表示哪一類反應?;
請分別舉出符合以上兩種情況的一個例子:; .
(3)下列說法正確的是 .
A.置換反應一定屬于氧化還原反應
B.有單質參加和有單質生成的化學反應一定是氧化還原反應
C.化學反應中有一種物質被氧化,必定有另外一種物質被還原
D.氧化還原反應發生的本質是化合價發生了變化.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學中有許多有趣的實驗,如下介紹的“藍瓶子”實驗就是一例。 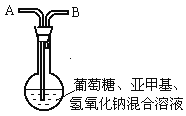
在250 mL平底燒瓶中依次加入2g氫氧化鈉、100mL蒸餾水、2g葡萄糖(粉末),振蕩使其溶解。滴入4~6滴0.2%的亞甲基藍溶液,塞上瓶塞(如圖),振蕩燒瓶,溶液呈藍色。靜置,約3分鐘后藍色消失,變為無色。再次振蕩,無色溶液又呈藍色。可反復多次。為探究是什么原因引起的,有人做了以下實驗。
①從燒瓶中取出溶液注滿一支試管,塞上橡皮塞。試管中的溶液由藍色變為無色,再振蕩試管溶液不能變藍。
②在原燒瓶中經A處鼓入空氣,又慢慢變藍了。靜置片刻后,藍色又消失。再次鼓入空氣,又慢慢變藍。
③為了進一步弄清是何種成分引起的,他又繼續探索。從A處改通純凈的N2、CO2 , 都不能使燒瓶中的無色溶液變藍。把制得的氧氣從A處通入,發現上述無色溶液慢慢變為藍色,到此為止,“藍瓶子”實驗原理有了科學結論,請總結“藍瓶子”實驗的變色原理:。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以磷石膏(只要成分CaSO4 , 雜質SiO2、Al2O3等)為原料可制備輕質CaCO3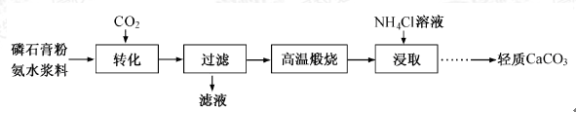
(1)
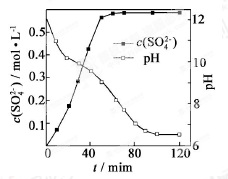
(2)當清液pH接近6.5時,過濾并洗滌固體。濾液中物質的量濃度最大的兩種陰離子為 和 (填化學式);檢驗洗滌是否完全的方法是 。
(3)在敞口容器中,用NH4Cl溶液浸取高溫煅燒的固體,隨著浸取液溫度上升,溶液中c(Ca2+)增大的原因 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com