
分析 (1)①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(l)?H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根據蓋斯定律,方程式①-3×②-2×③得到方程2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),據此計算△H;
(2)當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
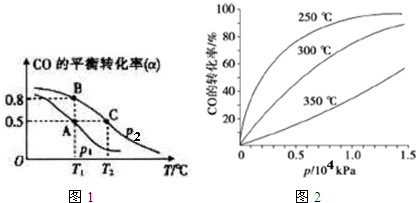
(3)①由圖1可知,壓強一定時,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動;
②平衡常數與濃度、壓強無關,只與溫度有關,結合平衡移動判斷;增大壓強平衡正移,CO的轉化率增大;
③A、B兩點溫度相等,壓強不同,平衡常數相同,利用三段式計算A、B兩點平衡時各組分物質的量,根據A點各物質的濃度計算平衡常數,再根據平衡常數計算B點體積;
④由圖3可知,在250°C、1.3x104kPa左右,時CO的轉化率已較高,再增大壓強CO轉化率提高不大,且增大成本.
解答 解:(1)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根據蓋斯定律,則①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,則:△H=△H1-3△H2-2△H3,
故答案為:H=△H1-3△H2-2△H3;
(2)A.2v(H2)=v (CO)中未指明正逆速率,不能說明得到平衡,故A錯誤;
B.平衡常數與濃度、壓強無關,只與溫度有關,溫度一定時平衡常數為定值,絕熱密閉容器中,容器中的溫度隨著反應進行不斷變化,則平衡常數不斷變化,當平衡常數不變時說明達到了平衡狀態,故B正確;
C.容器體積不變,混合氣體總質量不變,混合氣體密度始終保持不變,不能說明得到平衡,故C錯誤;
D.混合氣體總質量不變,隨反應進行氣體物質的量減小,混合氣體平均相對分子質量減小,當混合氣體的平均相對分子質量不隨時間而變化,說明反應到達平衡,故D正確,
故答案為:BD;
(3)①由圖1可知,壓強一定時,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動,即正反應為放熱反應,故答案為:放熱;
②平衡常數與壓強無關,只與溫度有關,A、B溫度相等,則KA=KB,相同壓強下,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動,則平衡常數減小,故KB>KC,故KA=KB>KC;增大壓強平衡正移,CO的轉化率增大,已知P2條件下,CO的轉化率大,則P1<P2;
故答案為:KA=KB>KC; P1<P2;
③A、B兩點溫度相等,壓強不同,平衡常數相同,
對應A點,CO轉化率為0.5,參加反應CO為10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
開始(mol):10 20 0
轉化(mol):5 10 5
平衡(mol):5 10 5
故T1溫度下,平衡常數K=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1
對應B點,CO轉化率為0.8,參加反應CO為10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
開始(mol):10 20 0
轉化(mol):8 16 8
平衡(mol):2 4 8
設平衡時的體積為VL,則$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2
故答案為:2.
④由圖3可知,在250°C、1.3x104kPa左右,CO的轉化率已較高,再增大壓強CO轉化率提高不大,且增大生成成本,得不償失,故選擇250°C、1.3x104kPa左右,
故答案為:在1.3×104Pa下,CO的轉化率已較高,再增大壓強,CO的轉化率提高不大,生產成本卻增加.
點評 本題考查化學平衡常數有關計算、化學平衡圖象及影響因素、化學平衡狀態判斷、反應熱計算,注意掌握化學平衡常數的應用,掌握三段式計算方法,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 一氯代烷烴,隨C原子數的增多,密度依次增大 | |
| B. | 常溫下,正戊烷、異戊烷、新戊烷的沸點依次增大 | |
| C. | 飽和一元羧酸,隨C原子數的增多,酸性逐漸減弱 | |
| D. | 鄰-二甲苯、間-二甲苯,對-二甲苯的沸點依次升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中緩慢通入CO2至溶液增重8.8 g時,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常溫下,將CH3COONa溶液和稀鹽酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常溫下,pH=3的醋酸溶液和pH=13的氫氧化鈉溶液等體積混合后(不考慮混合后溶液體積的變化),恰好完全反應,則原醋酸溶液醋酸的電離度為1% | |
| D. | 物質的量濃度之比為1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 溫度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
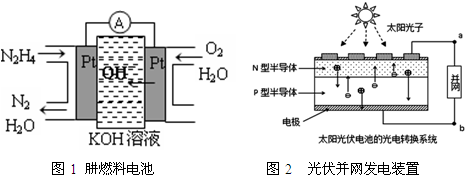
| A. | 氫氧燃料電池、太陽光伏電池中都利用了原電池原理 | |
| B. | 圖1左邊電極上發生的電極反應式為:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 圖2中N型半導體為正極,P型半導體為負極 | |
| D. | LED中的Ga和Y不可能都顯+3價 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚乙烯食品包裝袋、食物保鮮膜都是無毒的高分子材料 | |
| B. | 高溫能殺死流感病毒是因為構成病毒的蛋白質受熱變性 | |
| C. | 太陽能電池板中的硅是硅單質,光導纖維的主要成分是二氧化硅 | |
| D. | 明礬[KAl(SO4)2•12H2O]常用于自來水的凈化、殺菌消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為防止食品氧化變質,食品袋中放有硅膠包 | |
| B. | 酒精用來殺菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油與礦物油可以通過水解反應區分 | |
| D. | 明礬凈水時發生了化學及物理變化,能起到殺菌、消毒的作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 銅、錳及其合金是人類常用的金屬材料.
銅、錳及其合金是人類常用的金屬材料.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com