
【題目】Ⅰ.某校化學實驗興趣小組為了驗證在實驗室制備Cl2的過程中有水蒸氣和HCl揮發出來,同時證明Cl2的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),請按要求回答下列問題。
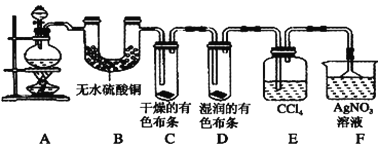
(1) 實驗室制備Cl2所用的化學藥品是________。
寫出該反應的離子方程式,并用單線橋表示電子轉移情況_____________________ ,此反應中每轉移0.8mol電子,消耗Hcl____mol
(2)①裝置B的作用是_______
②裝置C和D出現的不同現象說明的問題是___
③裝置E的作用是_______
(3)乙同學認為甲同學的實驗有缺陷,不能確保最終通入AgNO3溶液中的氣體只有一種。為了確保實驗結論的可靠性,證明最終通入AgNO3溶液中的氣體只有一種,乙同學提出應該在裝置___與___之間(填裝置字母序號)增加一個裝置,所增加裝置里面的試劑可以為___(填字母序號)。
A.濕潤的碘化鉀淀粉試紙 B.濃硫酸 C.濕潤的紅色布條 D.飽和食鹽水
Ⅱ.洪災過后,飲用水的消毒殺菌成為抑制大規模傳染性疾病爆發的有效方法之一。漂白粉是常用的消毒劑。
①工業上將氯氣通入石灰乳[Ca(OH)2]制取漂白粉,化學反應方程式為:_____________。
②漂白粉的有效成分是________________________。
③漂白粉溶于水后,受空氣中的CO2作用,即產生有漂白、殺菌作用的次氯酸,化學反應方程為________。
【答案】二氧化錳和濃鹽酸 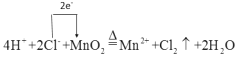 1.6mol 證明有水蒸氣產生 氯氣無漂白性,氯水有漂白性 吸收氯氣 E F A 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
1.6mol 證明有水蒸氣產生 氯氣無漂白性,氯水有漂白性 吸收氯氣 E F A 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
【解析】
Ⅰ. 裝置A是制備氯氣的發生裝置,生成的氯氣含水蒸氣和氯化氫,通過裝置B中硫酸銅檢驗生成水蒸氣并吸收水蒸氣,通過E中干燥的有色布條,不褪色證明氯氣無漂白性,通過裝置D中濕潤有色布條褪色,證明氯氣和水反應生成的次氯酸具有漂白性,通過裝置E中四氯化碳吸收氯氣,最后剩余氯化氫被氫氧化鈉溶液吸收,
Ⅱ.(1)根據氯氣與Ca(OH)2反應書寫化學方程式;
(2)漂白粉的有效成分為Ca(ClO)2;
(3)根據漂白粉中的有效成分與CO2作用,即產生次氯酸;
(1)實驗室用濃鹽酸和二氧化錳共熱制取氯氣,離子反應方程式為![]() ,根據方程式可知轉移0.8mol電子,消耗的HCl為1.6mol,
,根據方程式可知轉移0.8mol電子,消耗的HCl為1.6mol,
故答案為:二氧化錳和濃鹽酸; 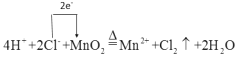 ;1.6mol;
;1.6mol;
(2)①無水硫酸銅常用來檢驗水蒸氣,故答案為:證明有水蒸氣產生;
②C和D的區別在于是否有水,現象不同說明了干燥的氯氣沒有漂白性,
故答案為:氯氣無漂白性,氯水有漂白性;
③尾氣中有氯氣需要處理,四氯化碳可以吸收氯氣,故答案為:吸收氯氣;
(3)氯氣、氯化氫通入到硝酸銀都會產生沉淀,為了確保實驗結論的可靠性,應在裝置E和F之間增加一個盛有濕潤的淀粉碘化鉀試紙或者濕潤的有色布條,如果濕潤的淀粉碘化鉀試紙不變藍或者濕潤的有色布條不褪色,則氯氣被完全吸收,
故答案為:E;F;AC。
Ⅱ. 1)因HClO具有漂白作用,但其不穩定,不好保存和使用,工業上常利用氯氣與氫氧化鈣反應來制取漂白粉,以用于漂白和消毒,Cl2與Ca(OH)2反應:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+H2O
故答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+H2O;
(2)次氯酸鈣是漂白粉的有效成分,它的化學式為Ca(ClO)2
故答案為:Ca(ClO)2;
(3)因碳酸的酸性比次氯酸的酸性強,所以碳酸可以與Ca(ClO)2反應:Ca(ClO)2+CO2+H2O=CaCO3+2HClO
故答案為:Ca(ClO)2+CO2+H2O=CaCO3+2HClO;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容。下列說法正確的是( )

A.該硫酸的物質的量濃度為9.2mol·L-1
B.該硫酸與等體積的水混合所得溶液的質量分數小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取該硫酸50.0mL
D.實驗室可用該硫酸制備氫氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁(熔點660℃)是一種應用廣泛的金屬,鎵(Ga)與鋁同主族,曾被稱為“類鋁”,其氧化物和氫氧化物均為兩性化合物。工業上以鋁土礦(含有Al2O3、Ga2O3、SiO2等物質)為原料提取Al2O3(熔點2045℃),并將Al2O3和冰晶石(Na3AlF6,六氟合鋁酸鈉)混合熔融后電解制得。回答下列問題:
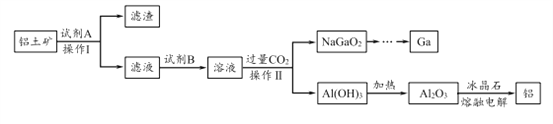
(1)冶金工業上常用金屬鋁作還原劑冶煉釩、鉻、錳等金屬,寫出鋁與CrO3在高溫下反應的化學方程式 ___________________。
(2)操作I得到濾渣的主要成分有________________ 。
(3)將0.1 mol/L AlCl3溶液和10% NH4F溶液等體積混合,充分反應后滴加氨水,無沉淀析出。則AlCl3與NH4F反應的化學方程式為 ________________ ;該實驗所用試管及盛裝NH4F溶液的試劑瓶均為塑料材質,原因是 _________________________。
(4)飲用水中的NO3-對人類健康會產生危害。為了降低飲用水中的NO3-的濃度,有研究人員建議在堿性條件下用鋁粉將NO3-還原為N2,該反應的離子方程式為_________ ,此方法的缺點是處理后的水中生成了AlO2-,仍然可能對人類健康產生危害,還需對該飲用水進行一系列后續處理。已知:25℃時,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13。25℃時,若欲使上述處理的水中AlO2-濃度降低到1.0×10-6 mol/L,則應調節至pH=____,此時水中
AlO2-+H++H2O K=1.0×10-13。25℃時,若欲使上述處理的水中AlO2-濃度降低到1.0×10-6 mol/L,則應調節至pH=____,此時水中![]() =__________。
=__________。
(5)工業上常用碳棒作電極電解熔融氧化鋁的方法冶煉鋁(如圖所示)。
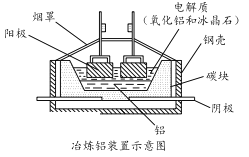
①陰極電極反應式為________________________ 。
②工業生產中,陽極材料要定期補充,其原因是:____________________。
(6)下列有關推理不合理的是 ______。
a.工業上可以用熱還原法來制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外層電子數相同可知,鎵與鋁的化學性質相似
d.可用GaCl3溶液、氨水和鹽酸設計實驗證明Ga(OH)3的兩性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鎳在電池和電鍍等工業上具有廣泛的用途,可鎳也具有很強的毒性,若不進行回收處理,將對環境造成很大的影響,以下是以電鍍廢渣為原料獲得NiSO46H2O的過程,已知,廢渣中除含金屬鎳外,主要含有:Cu、Zn、Fe、Mg等元素的化合物。
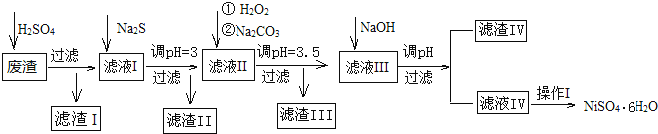
部分陽離子以氫氧化物或硫化物的形式完全沉淀時溶液的pH見表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(1)往廢渣中加H2SO4酸浸,提高酸浸效率的方法有__(至少寫出2點)。
(2)加Na2S同時調溶液的pH為3,目的是除去銅、鋅等雜質,則往濾液Ⅱ中加入H2O2的反應的離子方程式為___。
(3)操作Ⅰ包括以下過程:__、__、過濾、洗滌、干燥.該洗滌過程不能用水洗滌,應該用__洗滌,目的是___。干燥有低溫干燥和高溫干燥,能否用高溫干燥___,理由是____。
(4)濾液Ⅲ中加入NaOH溶液的目的是調節溶液的pH為8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常溫下當兩種沉淀共存且溶液的pH=8時,c(Mg2+):c(Al3+)=__。{已知:25℃時,Ksp[Mg(OH)2]=5.0×10-14;Ksp[Al(OH)3]=2.0×10-33}。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鈉-過氧化氫加合物(xNa2SO4 ·yH2O2·zH2O)的組成可通過下列實驗測定:
①準確稱取1.77g樣品,配制成100.00mL溶液A。
②準確量取25.00mL溶液A,加入鹽酸酸化的氯化鋇溶液至沉淀完全,過濾、洗滌、干燥至恒重,得到白色固體0.0025mol。
③準確量取25.00mL溶液A,加入適量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至終點(KMnO4只與加合物中的H2O2發生反應),消耗KMnO4溶液25.00mL。回答下列問題:
(1)在步驟①中,所需玻璃儀器除了燒杯外還需要________________;
(2)在步驟①中,下列操作會使所配溶液濃度偏低的是_______(填字母);
A.在溶解過程中有少量液體濺出燒杯外
B.定容時仰視儀器上的刻度線
C.定容后震蕩搖勻靜置,發現液面低于刻度線,于是又加入少量水至刻度線
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“堿式”)滴定管中,滴定終點的現象是____________________,寫出滴定中發生的離子反應方程式_______________;
(4)通過計算確定樣品的組成為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種利用失活的含鎳催化劑(含NiB、MgO及SiO2等)為原料制備超細鎳粉,其工藝流程如下:
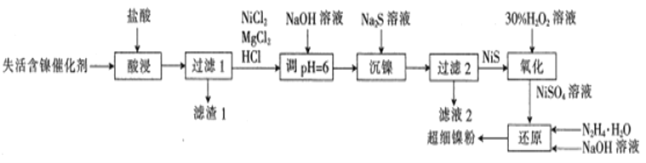
已知:pH=6時,Mg2+、Ni2+都不生成沉淀。
回答下列問題:
(1)非晶態NiB可由KBH4和Ni(NO3)2溶液反應制備。KBH4的電子式為_________
(2)“酸浸”時,為提高鎳的浸取率可采取的措施是___________ (列舉一點);濾值1中除了含有B單質外,還含有___________ (填化學式)。
(3)若流程中沒有“NaOH溶液調pH=6”,則導致的后果是________
(4)“氧化”時發生反應的化學方程式為_______________;氧化時溫度不宜超過50℃,其原因是_________________
(5)“還原”時產生無污染的氣體,“還原”時發生反應的離子方程式為___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下的aLHCl(g)溶于1000g水中,得到的鹽酸密度為bg·cm-3,則該鹽酸的物質的量濃度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈣線是煉制優質鋼材的脫氧脫磷劑,某鈣線的主要成分為金屬M和Ca,并含有3.5%(質量分數)CaO。
(1) Ca元素在周期表中位置是____,其原子結構示意圖____。
(2) Ca與最活躍的非金屬元素A形成化合物D,D的電子式為____,D的沸點比A與Si形成的化合物E的沸點____。
(3)配平用鈣線氧脫鱗的化學方程式____:P+FeO+CaO![]() Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
(4)將鈣線試樣溶于稀鹽酸后,加入過量NaOH溶液,生成白色絮狀沉淀并迅速變成灰綠色,最后變成紅褐色M(OH)n,則金屬M為______;檢測Mn+的方法是_____(用離子方程式表達)。
(5)取1.6 g鈣線試樣,與水充分反應,生成224 mL H2(標準狀況),再向溶液中通入適量的CO2,最多能得到CaCO3____g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A. 常溫常壓下,15g甲基(-CH3)所含的電子數為10NA
B. 常溫常壓,11.2L氦氣中含有的原子數為0.5NA
C. 標準狀況下,4.48L重水(D2O)中含有的中子數為2NA
D. 常溫常壓下,23gNO2和N2O4的混合物中含有NA個氧原子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com