
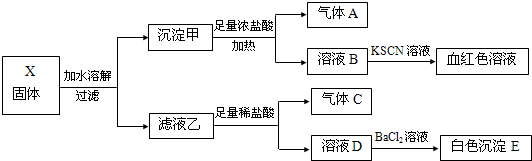
| A. | 固體X中一定含有Fe2O3 | |
| B. | 沉淀E可能含有BaSO3 | |
| C. | 氣體A、C一定均為純凈物 | |
| D. | 固體X可能出現含有K2SO3、K2CO3而不含Na2SO4的情況 |
分析 氣體A應為氯氣,則應含有MnO2,溶液B與KSCN溶液生成血紅色溶液,則說明B溶液中一定含有鐵離子,即固體中一定含有FeO和Fe2O3中的至少一種,由于有氯氣的存在,不能確定一定是Fe2O3,濾液乙于足量稀鹽酸反應生成氣體C,氣體C可以是二氧化碳或者二氧化硫,溶液D加入氯化鋇有白色沉淀,此沉淀一定為硫酸鋇,但是此前若固體中存在NaNO3,在足量的稀鹽酸中可以把亞硫酸根氧化生成硫酸根,以此解答該題即可.
解答 解:固體X加水溶解,固體加入足量的濃鹽酸加熱生成氣體,該氣體A應為氯氣,則應含有MnO2,溶液B與KSCN溶液生成血紅色溶液,則說明B溶液中一定含有鐵離子,即固體中一定含有FeO和Fe2O3中的至少一種,由于有氯氣的存在,不能確定一定是Fe2O3,濾液乙于足量稀鹽酸反應生成氣體C,氣體C可以是二氧化碳或者二氧化硫,溶液D加入氯化鋇有白色沉淀,此沉淀一定為硫酸鋇,但是此前若固體中存在NaNO3,在足量的稀鹽酸中可以把亞硫酸根氧化生成硫酸根,故固體中可能不存在Na2SO4,
A、依據分析可知,固體X中不一定含有Fe2O3,可能存在的是FeO,因為Fe2+可被氯氣氧化生成Fe3+,故A錯誤;
B、由于乙到D加入的是足量的稀鹽酸,故沉淀E不可能含有BaSO3,故B錯誤;
C、由分析可知:氣體C可以是二氧化碳、二氧化硫或者二者的混合氣體,故C錯誤;
D、由分析可知:固體X可能出現含有K2SO3、K2CO3而不含Na2SO4的情況,故D正確,故選D.
點評 本題考查物質的檢驗和鑒別的實驗方案的設計,側重于元素化合物知識的綜合運用,題目難度中等,注意把握反應的現象,根據現象結合物質的性質進行判斷.


 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:選擇題

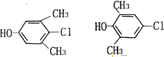
| A. | Y遇到氯化鐵溶液時顯紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3個手性碳原子 | |
| C. | 1mol X與足量NaOH溶液反應,最多可消耗3mol NaOH | |
| D. | 1個Y分子中最多有8個原子共面 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若某溫度下,0.2 mol/L的醋酸與0.09 mol/L的氫氧化鋇等體積混合后呈中性(不考慮混合后溶液體積的變化),則可算出該溫度下醋酸的電離常數 K=9×10-7 mol/L | |
| B. | 若某溫度下氯化銀的Ksp=10-10mol2/L2,則100 mL0.2 mol/L的氯化鈉溶液與0.18 mol/L硝酸銀溶液等體積混合后(不考慮混合后溶液體積的變化),溶液中c(Ag+)為10-8 mol/L | |
| C. | 若某溫度下1 L密閉容器中反應HCHO(g)十H2(g)?CH3OH(g)達到平衡后甲醛的轉化率為50%,則該溫度下該反應的平衡常數是2(mol/L)-1 | |
| D. | 若向氫氧化鈣的飽和溶液中加人氫氧化鈉溶液,則會有固體析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 (寫兩種)
(寫兩種) 的化學方程式
的化學方程式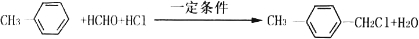 ,
,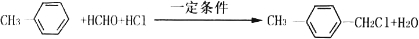 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C(g)的濃度與縮小體積前的平衡濃度相等 | |
| B. | 平衡時,單位時間內n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持體積不變,向平衡體系中加入少量的A,平衡不移動 | |
| D. | 若開始時向容器中加入1 mol B和1 molC,達到平衡時吸收熱量Q kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 萃取,蒸餾,分液 | B. | 分液,萃取,蒸餾 | C. | 蒸餾,萃取,分液 | D. | 分液,蒸餾,萃取 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 雙氧水分解時加入二氧化錳 | B. | 將塊狀藥品研細后在進行反應 | ||
| C. | 用較濃的鹽酸代替稀鹽酸與鋅反應 | D. | 將易腐敗的食物儲存在冰箱里 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CH3COOCH3+H2O.
CH3COOCH3+H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com