
 HSO3ˉ+OHˉ,下列說法正確的是
HSO3ˉ+OHˉ,下列說法正確的是| A.加入少量NaOH固體,Kw增大 |
| B.c(OHˉ)= c(HSO3ˉ)+2 c(H2SO3)+ c(H+) |
| C.c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ) |
| D.加入稀鹽酸,c(HSO3ˉ)減小 |
 HSO3ˉ+OHˉ、HSO3ˉ+H2O
HSO3ˉ+OHˉ、HSO3ˉ+H2O H2SO3+OHˉ,但是第一步水解程度較弱,第二水解程度更弱,兩步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正確;鹽酸與氫氧根離子易反應,能減小氫氧根離子濃度,使亞硫酸根離子的水解平衡右移,則c(HSO3ˉ)增大,故D錯誤。
H2SO3+OHˉ,但是第一步水解程度較弱,第二水解程度更弱,兩步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正確;鹽酸與氫氧根離子易反應,能減小氫氧根離子濃度,使亞硫酸根離子的水解平衡右移,則c(HSO3ˉ)增大,故D錯誤。

科目:高中化學 來源:不詳 題型:單選題
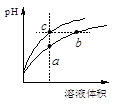
| A.a、c兩點溶液的導電能力相同 |
| B.b點溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三點溶液水的電離程度a>b>c |
| D.與等體積b、c處溶液反應,消耗等量的NaOH |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.c(OH¯)=1×10¯10mol·L¯1 |
| B.c(NH4+)>c(Cl¯)>c(H+)>c(OH¯) |
| C.c(NH3·H2O)=c(NH4+) |
| D.c(H+)+c(NH4+)=c(Cl¯)+ c(OH¯) |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.醋酸與醋酸鈉的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸銨溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.將1molKCl、1molNaHS溶于水配成1L混合溶液中: |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

| 難溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 廢水濃度 | 29.4g/L | 1.6g·L-1 |
| 排放標準 | pH 6~9 | 0.5mg·L-1 |
 HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。
HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 mB(g)隔一段時間對該容器內的物質進行分析,得到如下數據:
mB(g)隔一段時間對該容器內的物質進行分析,得到如下數據:| 時間(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題

| A.X、Y兩種堿溶液中溶質的物質的量濃度一定相等 |
| B.稀釋后,X溶液的堿性比Y溶液的堿性強 |
| C.分別完全中和X、Y這兩種堿溶液時,消耗同濃度鹽酸的體積Vx>Vy |
| D.若8<a<10,則X、Y都是弱堿 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
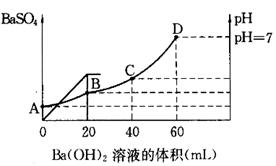
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com