
【題目】(1)氨氣極易溶于水,氨氣與水反應的化學方程式為____________________;氨水顯堿性的原因是_____________________________(用離子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分別加入下列物質:
A.濃氨水 B.純水 C.少量濃硫酸 D.少量NaOH固體 E.少量Al2(SO4)3固體
①能使c(OH-)減少、c(![]() )增大的是____(填字母,下同)。
)增大的是____(填字母,下同)。
②能使c(OH-)增大、c(![]() )減少的是____。
)減少的是____。
③能使c(OH-)和c(![]() )都增大的是____。
)都增大的是____。
④能使c(OH-)和c(![]() )都減少的是____。
)都減少的是____。
【答案】 NH3+H2O![]() NH3·H2O NH3·H2O
NH3·H2O NH3·H2O![]()
![]() +OH- CE D A B
+OH- CE D A B
【解析】(1)氨氣與水反應生成NH3·H2O,方程式為NH3+H2O![]() NH3·H2O;NH3·H2O為弱電解質,可電離出OH-,溶液呈堿性,電離方程式為NH3·H2O
NH3·H2O;NH3·H2O為弱電解質,可電離出OH-,溶液呈堿性,電離方程式為NH3·H2O![]() NH4++OH-。(2)氨水中存在電離平衡:NH3·H2O
NH4++OH-。(2)氨水中存在電離平衡:NH3·H2O![]() NH4++OH-,則①若使c(OH-)減少、c(NH4+)增大可加入與OH-反應的微粒,如硫酸中的H+能中和OH-,硫酸鋁溶液中Al3+與OH-生成Al(OH)3沉淀,使電離平衡右移,c(NH4+)增大,答案選CE;②若c(OH-)增大、c(NH4+)減少,可加入堿,如NaOH,答案選D;③加入濃氨水,可使c(OH-)和c(NH4+)都增大,答案選A;④稀釋促進電離,溶液體積增加的更多,能使c(OH-)和c(NH4+)都減少,答案選B。
NH4++OH-,則①若使c(OH-)減少、c(NH4+)增大可加入與OH-反應的微粒,如硫酸中的H+能中和OH-,硫酸鋁溶液中Al3+與OH-生成Al(OH)3沉淀,使電離平衡右移,c(NH4+)增大,答案選CE;②若c(OH-)增大、c(NH4+)減少,可加入堿,如NaOH,答案選D;③加入濃氨水,可使c(OH-)和c(NH4+)都增大,答案選A;④稀釋促進電離,溶液體積增加的更多,能使c(OH-)和c(NH4+)都減少,答案選B。


科目:高中化學 來源: 題型:
【題目】下列物質:①稀HNO3.②BaCl2溶液;③KI溶液;④NaAlO2溶液;⑤KSCN溶液;⑥酸性K2Cr2O7溶液,與Fe2(SO4)3不反應的是
A. ①⑥ B. ④⑥ C. ③④ D. ①④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A的分子式為C10H803能與NaHCO3反應,在一定條件下存在如下轉化關系:
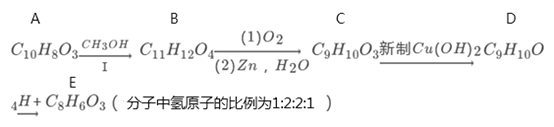
已知:
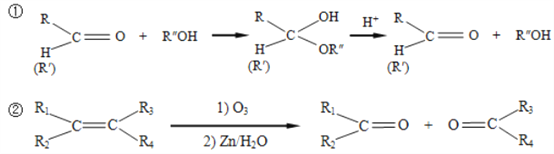
請回答下列問題:
(1)有機物A的結構簡式為:___________。
(2)有機物B中含氧官能團的名稱是:___________。
(3)反應I的作用為:___________。
(4)寫出C→D的化學方程式:___________。
(5)F(C8H8O3)是由E與氫氣在一定條件下反應得到的。F在一定條件下可以形成高分子,請寫出該反應的化學方程式:_____________。
(6)E有多種同分異構體,其中滿足下列條件的同分異構體共有______種(已知碳碳三鍵、碳碳雙鍵與羥基相連不穩定)。
A.除苯環外無其他環且無一O—O—鍵
B.能與FeCl3溶液發生顯色反應
C.苯環上一氯代物只有兩種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
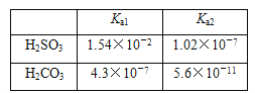
(1)在相同濃度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。
c(H+):H2SO3________H2CO3;c(SO![]() )________c(CO
)________c(CO![]() );c(H2SO3)________c(H2CO3);溶液導電能力:H2SO3________H2CO3。
);c(H2SO3)________c(H2CO3);溶液導電能力:H2SO3________H2CO3。
(2)HSO![]() 的電離平衡常數表達式為________________。
的電離平衡常數表達式為________________。
(3)H2SO3溶液與NaHCO3溶液反應的主要離子方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵族元素的單質(F2、Cl2、Br2、I2)與H2反應過程中的能量變化如右圖所示,其中a、b、c、d分別表示鹵族中某一元素的單質,△E為相同物質的量的單質與H2反應過程中的能量變化(△E越大,表明反應越容易發生).請回答下列問題: 
(1)d為 , 從d的水溶液中提取d的方法是 .
(2)紅熱的銅絲與b單質反應的現象為 .
(3)a與H2反應的化學方程式為 , b與H2反應的條件為 .
(4)由該能量變化示意圖可得出的結論是同一主族,自上而下,元素的非金屬性依次 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣里含有NO氣體是由于內燃機燃燒的高溫引起氮氣和氧氣反應所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知該反應在2 404 ℃時,平衡常數K=64×10-4。請回答:
2NO(g) ΔH>0。已知該反應在2 404 ℃時,平衡常數K=64×10-4。請回答:
(1)某溫度下,向2 L的密閉容器中充入N2和O2各1 mol,5分鐘后O2的物質的量為0.5 mol,則N2的反應速率為___。
(2)假定該反應是在恒容條件下進行,判斷該反應達到平衡的標志___(填字母序號)。
A.消耗1 mol N2同時生成1 mol O2
B.混合氣體密度不變
C.混合氣體平均相對分子質量不變
D.2v正(N2)=v逆(NO)
(3)將N2、O2的混合氣體充入恒溫恒容密閉容器中,下列變化趨勢正確的是__(填字母序號)。

(4)向恒溫恒容的密閉容器中充入等物質的量的N2和O2,達到平衡狀態后再向其中充入一定量NO,重新達到化學平衡狀態。與原平衡狀態相比,此時平衡混合氣體中NO的體積分數_____(填“變大”“變小”或“不變”)。
(5)該溫度下,某時刻測得容器內N2、O2、NO的濃度分別為2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此時反應________________(填“處于化學平衡狀態”“向正反應方向進行”或“向逆反應方向進行”),理由是_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com