
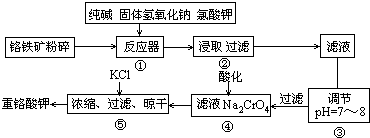
(15分)重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下,涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3
+7KCl+12H2O,
12Na2CrO4+3Fe2O3
+7KCl+12H2O,

試回答下列問題:
(1)在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式:
。
(2)操作③的目的是什么,用簡要的文字說明:
。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式:
。
(4)稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) %(保留小數點后兩位)。
 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:閱讀理解
| ||

| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | 0 |
| 5 | 0.0033 | 0.103 | 0.447 | 0 |
| 6 | 0.0319 | 0.0999 | 0.437 | 0 |
| 7 | 0.2745 | 0.086 | 0.3195 | 0 |
| 8 | 0.902 | 0.0282 | 0.0347 | 0 |
| 9 | 0.996 | 0.0031 | 0.0004 | 0 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下,涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3 +7KCl+12H2O
12Na2CrO4+3Fe2O3 +7KCl+12H2O

試回答下列問題:
(1)在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式: 。
(2)操作③的目的是什么,用簡要的文字說明: 。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式: 。
(4)稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com