【答案】
分析:A、B、C、D都是短周期元素,根據原子半徑D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相對位置為:
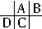
,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.
C原子最外層電子數是D原子最外層電子數的3倍,若D的最外層電子數為1,則C為鋁元素,A為硼元素,D為鈉元素;若D的最外層電子數為2,則C為硫元素,A為氧元素,不合題意.
所以A為硼元素,B為氧元素,C為鋁元素,D為鈉元素.
根據原子結構特點判斷元素所在周期表中位置,結合元素周期律的遞變規律比較離子半徑大小.
解答:解:A、B、C、D都是短周期元素,根據原子半徑D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相對位置為:
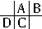
,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.
C原子最外層電子數是D原子最外層電子數的3倍,若D的最外層電子數為1,則C為鋁元素,A為硼元素,D為鈉元素;若D的最外層電子數為2,則C為硫元素,A為氧元素,不合題意.
所以A為硼元素,B為氧元素,C為鋁元素,D為鈉元素.
A、B為氧元素,C為鋁元素,D為鈉元素,B、C、D三種元素組成的化合物的化學式為NaAlO
2,故A錯誤;
B、A為硼元素,C為鋁元素,最外層電子數都為3,兩元素處在元素周期表中的第ⅢA族,故B錯誤;
C、B、C、D三種元素的簡單離子分別為O
2-、Al
3+、Na
+,三種離子核外電子排布相同,核電核數越大,離子半徑越小,則有O
2->Na
+>Al
3+,故C錯誤;
D、B為氧元素,D為鈉元素,B、D兩元素組成的離子化合物Na
2O、Na
2O
2中陰、陽離子的個數比都為1:2,故D正確.
故選D.
點評:本題考查位置結構性質的相互關系及應用,題目難度中等,注意根據原子的結構特點判斷元素的種類,把握離子半徑的比較方法.

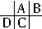 ,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.
,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.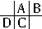 ,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.
,C原子序數等于A原子序數+8,C原子核內的質子數等于A、B原子核內的質子數之和,故B原子序數為8,故B為氧元素.

 激活思維優加課堂系列答案
激活思維優加課堂系列答案 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案


