
【題目】(1)按要求表示下列有機物:
①相對分子質量為72且沸點最低的烷烴的結構簡式:____。
②順-2-丁烯的結構簡式:____________。
③某炔烴經催化加氫后可得到2-甲基丁烷,則該炔烴的名稱是(按系統命名法命名):______。
(2)某有機物X分子中只含C、H、O三種元素,相對分子質量小于110,其中氧元素的質量分數為14.8%。已知該物質可與FeCl3溶液發生顯色反應,則X的分子式為_____;若1molX與濃溴水反應時可消耗3molBr2,則X的結構簡式為_____。
(3)按要求寫出下列反應的化學方程式:
①實驗室制備乙炔的化學方程式:__________。
②2-溴丙烷與氫氧化鈉水溶液共熱的化學方程式:_____。
【答案】C(CH3)4 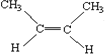 3-甲基-1-丁炔 C7H8O
3-甲基-1-丁炔 C7H8O  CaC2+2H2O→Ca(OH)2+C2H2↑ CH3CH(Br)CH3+NaOH
CaC2+2H2O→Ca(OH)2+C2H2↑ CH3CH(Br)CH3+NaOH![]() CH3CH(OH)CH3+NaBr
CH3CH(OH)CH3+NaBr
【解析】
(1)①烷烴只含C、H兩種元素的飽和烴;在烷烴中C的數目越多,沸點越高,支鏈越多,沸點越低,相對分子質量為72,說明含有5個C、12個H,其結構簡式:C(CH3)4,故答案為:C(CH3)4;
②丁烯含有4個碳,且有碳碳雙鍵,順-2-丁烯的結構簡式: ,故答案為:
,故答案為: ;
;
③炔烴含有碳碳三鍵,經催化加氫后可得到2-甲基丁烷,則該炔烴的名稱為:3-甲基-1-丁炔,故答案為:3-甲基-1-丁炔。
(2) 有機物X分子中只含C、H、O三種元素,相對分子質量小于110,其中含氧的質量分數為14.8%,分子中氧原子最大數目小于![]() ,故X中氧原子數目為1,M(X)=
,故X中氧原子數目為1,M(X)=![]() ,該物質可與FeCl3溶液發生顯色反應,說明含有酚羥基,假設為二元取代,減去1個-C6H4-、1個-OH后,剩余基團的式量為:108-76-17=15,則剩余基團為-CH3,故X的分子式為C7H8O,則X為甲基苯酚;若1molX與濃溴水反應時可消耗3molBr2,溴發生酚羥基的鄰、對位取代,故X中甲基與酚羥基處于間位位置,則X的結構簡式為:
,該物質可與FeCl3溶液發生顯色反應,說明含有酚羥基,假設為二元取代,減去1個-C6H4-、1個-OH后,剩余基團的式量為:108-76-17=15,則剩余基團為-CH3,故X的分子式為C7H8O,則X為甲基苯酚;若1molX與濃溴水反應時可消耗3molBr2,溴發生酚羥基的鄰、對位取代,故X中甲基與酚羥基處于間位位置,則X的結構簡式為: ,故答案為:C7H8O;
,故答案為:C7H8O; ;
;
(3) ①實驗室用電石和水制備乙炔,其化學方程式:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案為:CaC2+2H2O→Ca(OH)2+C2H2↑;
②2-溴丙烷與氫氧化鈉水溶液共熱,溴原子被羥基取代,其化學方程式:CH3CH(Br)CH3+NaOH![]() CH3CH(OH)CH3+NaBr,故答案為:CH3CH(Br)CH3+NaOH
CH3CH(OH)CH3+NaBr,故答案為:CH3CH(Br)CH3+NaOH![]() CH3CH(OH)CH3+NaBr。
CH3CH(OH)CH3+NaBr。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列關系正確的是( )
A.沸點:正丁烷>2-甲基丁烷
B.密度:CCl4>苯
C.等質量的物質燃燒耗O2量:乙烷>甲烷
D.等物質的量物質燃燒耗O2量:乙醇>乙烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物A經李比希法和質譜法分析得知其相對分子質量為136,分子式為C8H8O2。A的核磁共振氫譜有4個峰且面積之比為1∶2∶2∶3,A分子中只含一個苯環且苯環上只有一個取代基,其紅外光譜與核磁共振氫譜如圖。關于A的下列說法中,不正確的是( )

A.A屬于芳香化合物
B.A的結構簡式為![]()
C.A屬于羧酸類化合物
D.在紅外光譜圖中可以獲得分子中含有的化學鍵或官能團的信息
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國是一個嚴重缺水的國家,污水治理越來越引起人們重視,可以通過膜電池除去廢水中的乙酸鈉和對氯苯酚,其原理如圖所示,下列說法不正確的是

A. 電流方向從A極沿導線經小燈泡流向B極
B. B極為電池的陽極,電極反應式為CH3COO—— 8e + 4H2O ═ 2HCO3—+9H+
C. 當外電路中有0.2 mol e轉移時,通過質子交換膜的H+的個數為0.2NA
D. A極的電極反應式為![]() + H++2e ═ Cl+
+ H++2e ═ Cl+ ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在1L恒容密閉容器中加入lmol的N2(g)和3molH2(g)發生反應:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物質的量與時間的關系如下表所示,下列說法不正確的是( )
2NH3(g) △H<0, NH3的物質的量與時間的關系如下表所示,下列說法不正確的是( )
時間(min) | 0 | t1 | t2 | t3 |
NH3物質的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3時再加入1mol的N2(g)和3molH2(g),反應達新平衡時,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高溫度,可使正反應速率減小,逆反應速率增大,故平衡逆移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】面對目前世界范圍內的能源危機,甲醇作為一種較好的可再生能源,具有廣泛的應用前景。
(1)已知在常溫常壓下反應的熱化學方程式:
①CO(g)+2H2(g)CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
寫出由二氧化碳、氫氣制備甲醇的熱化學方程式:_______________________。
(2)在容積為VL的容器中充入amol CO與2amol H2,在催化劑作用下反應生成甲醇,平衡時的轉化率與溫度、壓強的關系如圖所示。
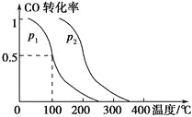
①p1 ________ p2(填“大于”、“小于”或“等于”);
②在溫度、體積不變的情況下,再增加amol CO與2amol H2,達到新平衡時,CO的轉化率________(填“增大”、“減小”或“不變”),平衡常數_____(填“增大”、“減小”或“不變”)。
(3)已知在T℃時,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常數K=0.32,在該溫度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某時刻經測定CO的轉化率為10%,則該反應________(填“已經”或“沒有”)達到平衡,此時刻υ正 ______υ逆 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一些常見的單質、化合物之間的轉化關系圖,有些反應中的部分物質被略去。反應①常被應用于野外焊接鋼軌,②是工業上重要的反應之一。
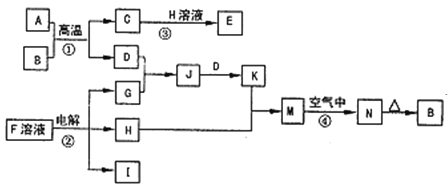
請回答下列問題:
(1)H的電子式是___,其中含有的化學鍵類型是___。
(2)寫出反應④的現象:___,有關反應的化學方程式為___。
(3)已知I的燃燒熱是-285.8kJmol-1,則1m3(標準狀況)I完全燃燒,恢復至室溫時放出的熱量是__(計算結果保留3位有效數字)。
(4)25℃時,以Pt為電極電解含有少量酚酞的F的飽和溶液,則在___(填“陰”或“陽”)極附近溶液由無色變為紅色,若在此極收集到0.2g氣體,則此時溶液的pH是__(假設溶液的體積為2L且不考慮電解后溶液體積的變化)。
(5)在K溶液中加入與K等物質的量的Na2O2,恰好使K轉化為N。寫出該反應的離子方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵是地殼中含量非常豐富的元素,金屬鐵是在高爐中冶煉的,在冶金工業中,常用焦炭來冶煉鐵。
(1)寫出焦炭在高爐中所參加的兩個反應的化學方程式: ________________。
(2)寫出赤鐵礦被![]() 還原成鐵的化學方程式:__________________________。
還原成鐵的化學方程式:__________________________。
(3)實驗室中可用![]() 還原
還原![]() ,在加熱
,在加熱![]() 前應先_________,否則可能發生________現象;未反應完的
前應先_________,否則可能發生________現象;未反應完的![]() ___________(填“能”或“不能”)排放到大氣中,應做________處理。
___________(填“能”或“不能”)排放到大氣中,應做________處理。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見的太陽能電池有單晶硅或多晶硅太陽能電池、GaAs太陽能電池及銅銦鎵硒薄膜太陽能電池等。請回答下列問題:
(1)基態硒原子的價電子排布式為___;H2O的沸點高于H2Se的沸點(-42℃),其原因是___。
(2)已知GaCl3晶體熔點為77.9℃,沸點為201.3℃,GaCl3品體類型為____。
(3)Na3AsO4中陰離子的空間構型為_____,As原子采取_____雜化。
(4)高溫下CuO容易轉化為Cu2O,試從原子結構角度解釋原因:_____。
(5)鋅與銅位于同一周期。硫化鋅的晶胞結構如圖所示,S2-周圍等距離且最近的Zn2+個數為____;若晶胞邊長為dpm,則硫化鋅的密度為____g·cm-3(不必簡化)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com