
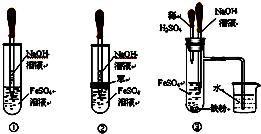
分析 (1)氫氧化亞鐵能夠與空氣中氧氣發生反應4Fe(OH)2+O2+2H2O=4Fe(OH)3,要較長時間保存Fe(OH)2沉淀,只要滿足在制取過程中盡可能減少和空氣接觸即可,據此對各選項進行判斷;
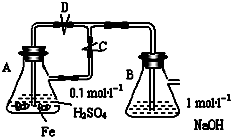
(2)①打開C后鐵與硫酸反應生成氫氣,關閉C后A中壓強增大,硫酸亞鐵溶液進入B,反應生成氫氧化亞鐵白色沉淀;
②若彈簧夾C關閉一會兒,容器A中的反應還在進行時,B容器中仍有氧氣,利用A產生的氫氣產生的壓強將硫酸亞鐵壓入錐形瓶B中,在錐形瓶B中生成氫氧化亞鐵,則B中應該盛放氫氧化鈉溶液,生成的氫氧化亞鐵,B容器中仍有氧氣,生成的氫氧化亞鐵被空氣氧化生成氫氧化鐵.
解答 解:(1)根據題中信息可知要較長時間保存Fe(OH)2沉淀,必須在制取過程中盡可能減少和空氣接觸,②中盛有氫氧化鈉溶液的滴管伸入放有還原性鐵粉的硫酸亞鐵溶液中,可以避免試管中部分氧氣對氫氧化亞鐵的氧化,則能減少與氧氣接觸;③Fe和稀硫酸生成氫氣能排出裝置中的氧氣,所以也能減少與氧氣接觸,只有①生成的氫氧化亞鐵能夠與空氣中氧氣發生反應:4Fe(OH)2+O2+2H2O=4Fe(OH)3,導致不能長時間觀察到氫氧化亞鐵,
故答案為:②③;
(2)①若先打開C,H2進入B,驅出B中O2,再關閉C,A中Fe2+進入B,只能生成Fe(OH)2,故答案為:開始時容器B中的導管口有氣泡冒出,彈簧夾關閉后容器A中溶液進入容器B,有白色沉淀生成;
②若開始關閉C,A中反應生成H2,壓強增大,A中溶液由導管進入B,B中Fe2+與OH-反應生成Fe(OH)2白色沉淀,Fe(OH)2與B中O2反應生成紅褐色沉淀Fe(OH)3,反應的化學方程式為:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案為:有白色沉淀生成,沉淀迅速變為灰綠色,最后變成紅褐色;2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3.
點評 本題考查鐵的相關知識和鐵的化合物之間的轉化,除雜、檢驗等內容,注意方程式的書寫,難度不大.


科目:高中化學 來源: 題型:選擇題
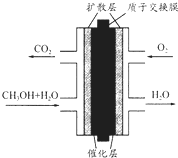 直接甲醇燃料電池(DMFC)有望取代傳統電池,它主要由陰極極板、陽極極板和膜電極構成,其中膜電極包括質子膜、催化劑層和氣體擴散層(如圖).下列關于DMFC工作原理的敘述正確的是( )
直接甲醇燃料電池(DMFC)有望取代傳統電池,它主要由陰極極板、陽極極板和膜電極構成,其中膜電極包括質子膜、催化劑層和氣體擴散層(如圖).下列關于DMFC工作原理的敘述正確的是( )| A. | 通入O2的電極反應式為:O2+4e-+2H2O═4OH- | |
| B. | 電池內部H+由正極滲過交換膜向負極移動 | |
| C. | 甲醇在正極發生反應,電流經過外電路流向負極 | |
| D. | 注入CH3OH的電極反應式為:CH3OH+H2O-6e-═CO2+6H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | Al2O3、SiCl4均為共價化合物 | |
| B. | 生產過程中均涉及氧化還原反應 | |
| C. | 石英可用于制光導纖維,晶體Si常用做半導體材料 | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用于冶煉鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na202與足量H20反應生成標況下11.2L 02.轉移電子的數目為2NA | |
| B. | 標準狀況下,2.24L S03中所含電子數為4NA | |
| C. | 用惰性電極電解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液復原,則電路中轉移電子的數目為0.2NA | |
| D. | 0℃和101kp的條件下,1.12L甲烷完全燃燒生成的水分子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
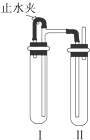 用下面兩種方法均可制得Fe(OH)2白色沉淀.
用下面兩種方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
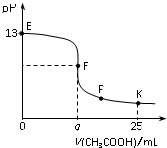 25℃時,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的變化曲線如圖所示,下列分析結論正確的是( )
25℃時,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的變化曲線如圖所示,下列分析結論正確的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 對應曲線上E、F之間的任何一點,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P點時,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K點時,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
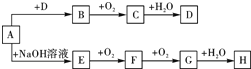 A~H等8種物質存在如下轉化關系(反應條件,部分產物未標出).已知:A是正鹽,B是能使品紅溶液褪色的氣體,G是紅棕色氣體.按要求回答問題:
A~H等8種物質存在如下轉化關系(反應條件,部分產物未標出).已知:A是正鹽,B是能使品紅溶液褪色的氣體,G是紅棕色氣體.按要求回答問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com