

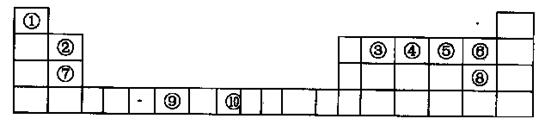
 該配離子中含有的化學鍵類型有 (填字母編號)。
該配離子中含有的化學鍵類型有 (填字母編號)。 (E+未畫出),該藍色晶體的一個晶胞中E+的個數為 個。
(E+未畫出),該藍色晶體的一個晶胞中E+的個數為 個。
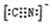 4
4  X4,F3+為
X4,F3+為 X4,AB-為
X4,AB-為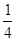 X12=3,根據電荷數整體為0的原則,該藍色晶體晶胞的
X12=3,根據電荷數整體為0的原則,該藍色晶體晶胞的 (E+未畫出),
(E+未畫出), 個中的E+為
個中的E+為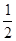 。則該藍色晶體的一個晶胞中E+的個數為8x1/2="4"
。則該藍色晶體的一個晶胞中E+的個數為8x1/2="4" 

科目:高中化學 來源:不詳 題型:填空題


查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:推斷題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

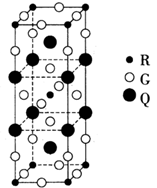
| A.NaN3與KN3結構類似,前者晶格能較小 |
B.晶體鉀的晶胞結構如圖所示: ,每個晶胞中分攤2個鉀原子 ,每個晶胞中分攤2個鉀原子 |
| C.氮的第一電離能大于氧 |
| D.氮氣常溫下很穩定,是因為氮的電負性小 |
 Rx[CrCln(H2O)6-n]+xH+。將含0.0015 mol[CrCln(H2O)6-n]x+的溶液,與R-H完全交換后,中和生成的H+需濃度為0.1200 mol·L-1 NaOH溶液25.00 mL,則該配離子的化學式為_______。
Rx[CrCln(H2O)6-n]+xH+。將含0.0015 mol[CrCln(H2O)6-n]x+的溶液,與R-H完全交換后,中和生成的H+需濃度為0.1200 mol·L-1 NaOH溶液25.00 mL,則該配離子的化學式為_______。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
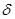 鍵與
鍵與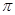 鍵的個數比為 。
鍵的個數比為 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com