
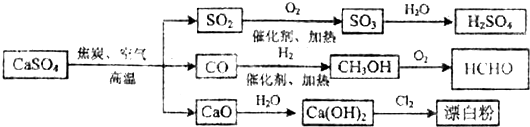
| A. | 除去與水反應外,圖示中其它的轉化反應均為氧化還原反應 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工業上利用Cl2和澄清石灰水反應來制取漂白粉 | |
| D. | 用CO合成CH3OH 進而合成HCHO的兩步反應,原子利用率均為100% |
分析 A.凡是有化合價升降的反應都是氧化還原反應;
B.酸性氧化物是一類能與水作用生成酸或與堿作用生成鹽和水或與堿性氧化物反應生成鹽的氧化物;
C.工業上常用氯氣和消石灰反應來制取漂白粉;
D.原子利用率是指反應物中的所有原子進入期望產物中的百分比.
解答 解:A.除去與水反應,圖示轉化反應都是與氧氣反應或氫氣反應,都一定有化合價升降,均為氧化還原反應,故A正確;
B.CO不能與堿反應,不是酸性氧化物,故B錯誤;
C.澄清石灰水中氫氧化鈣的濃度較小,應用純凈的消石灰,故C錯誤;
D.工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反應Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
反應Ⅱ中不是所有原子進入期望產物,原子利用率不為100%,故D錯誤.
故選A.
點評 本題考查酸性氧化物、氧化還原反應、漂白粉的制取、原子利用率,難度不大,注意澄清石灰水中氫氧化鈣的濃度較小,應用純凈的消石灰制取漂白粉.


 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
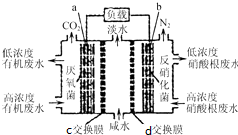 一種三室微生物燃料電池(MFC)污水凈化系統原理如圖所示,圖中廢水有機物可用C6H10O5表示.有關說法不正確的是( )
一種三室微生物燃料電池(MFC)污水凈化系統原理如圖所示,圖中廢水有機物可用C6H10O5表示.有關說法不正確的是( )| A. | 電子從a極經負載到b極 | |
| B. | c為氯離子交換膜,d為鈉離子交換膜,中間室可用作海水淡化 | |
| C. | 負極反應式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反應后將左右兩室溶液混合較反應前兩室溶液混合的酸性強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 用圖1所示裝置制取氨氣 | |
| B. | 用圖2所示裝置量取20.0ml的H2SO4待測液放入錐形瓶中 | |
| C. | 用圖3所示裝置用CaC2和飽和食鹽水反應制取C2H2 | |
| D. | 用圖4所示裝置可證明乙醇發生消去反應生成了乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
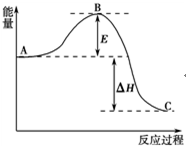 2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.請回答下列問題:
2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用催化劑能改變反應限度 | |
| B. | 升高溫度,則反應速率減慢 | |
| C. | 四種物質的量濃度相等時,則一定達到了該反應的限度 | |
| D. | 各物質的濃度不再發生變化時,則達到化學反應的限度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com