
【題目】甲、乙實驗小組設計如下實驗裝置分別制備SnCl4和漂白粉。
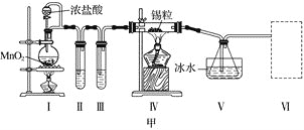
(1)已知:a.金屬錫熔點231 ℃,化學活潑性與鐵相似;
b.干燥的氯氣與熔融金屬錫反應生成SnCl4,SnCl4的沸點114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有機溶劑,且Sn2+易被氧化。根據圖甲裝置回答:
①試管Ⅱ中的試劑是____________________,Ⅲ中的試劑是________________________。
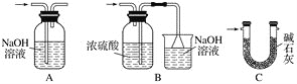
②Ⅵ處裝置最好選用________(填字母)。
③Ⅰ處裝置中反應的離子方程式是____________________________________________。
④實驗結束后,欲回收利用裝置Ⅰ中未反應完的MnO2,需要的玻璃儀器有______________。
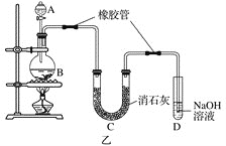
(2)已知:①Cl2與潮濕的消石灰反應是放熱反應;②溫度較高時Cl2與潮濕Ca(OH)2的反應為6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根據圖乙裝置回答:此實驗所得Ca(ClO)2產率較低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
【答案】飽和食鹽水 濃H2SO4 C MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 普通漏斗、玻璃棒、燒杯 B、C之間缺少吸收HCl的裝置,2HCl+Ca(OH)2===CaCl2+2H2O Cl2與消石灰反應為放熱反應,溫度升高,部分Ca(OH)2轉化為Ca(ClO3)2
Mn2++Cl2↑+2H2O 普通漏斗、玻璃棒、燒杯 B、C之間缺少吸收HCl的裝置,2HCl+Ca(OH)2===CaCl2+2H2O Cl2與消石灰反應為放熱反應,溫度升高,部分Ca(OH)2轉化為Ca(ClO3)2
【解析】
(1) ①裝置Ⅰ中制取的氯氣含有氯化氫和水蒸氣,錫與鹽酸反應生成SnCl2和氫氣,SnCl4易水解,所以制備SnCl4,要用干燥純凈的氯氣與錫反應,裝置Ⅱ、Ⅲ的作用是除雜和干燥;②根據SnCl4易水解,裝置Ⅵ處連接的裝置應具有干燥和吸收氯氣的作用。③Ⅰ處裝置中二氧化錳與濃鹽酸加熱生成氯化錳、氯氣、水;④MnO2難溶于水,實驗結束后,用過濾法回收裝置Ⅰ中未反應完的MnO2;(2)氯氣中含有雜質氯化氫,氯化氫與氫氧化鈣反應生成氯化鈣;Cl2與潮濕的消石灰反應是放熱反應,溫度升高,Cl2與潮濕Ca(OH)2的反應為6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
(1) ①裝置Ⅰ中制取的氯氣含有氯化氫和水蒸氣,錫與鹽酸反應生成SnCl2和氫氣,SnCl4易水解,所以制備SnCl4,要用干燥純凈的氯氣與錫反應,裝置Ⅱ、Ⅲ的作用是除雜和干燥,裝置Ⅱ中盛放飽和食鹽水,除去氯氣中的氯化氫;裝置Ⅲ中盛放濃H2SO4除去氯氣中的水蒸氣;②根據SnCl4易水解,裝置Ⅵ處連接的裝置應具有干燥和吸收氯氣的作用,故選C。③Ⅰ處裝置中二氧化錳與濃鹽酸加熱生成氯化錳、氯氣、水,反應的離子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;④MnO2難溶于水,實驗結束后,用過濾法回收裝置Ⅰ中未反應完的MnO2,需要的玻璃儀器是普通漏斗、玻璃棒、燒杯;(2) 氯氣中含有雜質氯化氫,B、C之間缺少吸收HCl的裝置,2HCl+Ca(OH)2===CaCl2+2H2O ; Cl2與消石灰反應為放熱反應,溫度升高,Cl2與潮濕Ca(OH)2的反應為6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,部分Ca(OH)2轉化為Ca(ClO3)2。
Mn2++Cl2↑+2H2O;④MnO2難溶于水,實驗結束后,用過濾法回收裝置Ⅰ中未反應完的MnO2,需要的玻璃儀器是普通漏斗、玻璃棒、燒杯;(2) 氯氣中含有雜質氯化氫,B、C之間缺少吸收HCl的裝置,2HCl+Ca(OH)2===CaCl2+2H2O ; Cl2與消石灰反應為放熱反應,溫度升高,Cl2與潮濕Ca(OH)2的反應為6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,部分Ca(OH)2轉化為Ca(ClO3)2。


 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.標準狀況下,22.4 L水中所含的分子數約為6.02×1023個
B.1 mol Cl2中含有的原子數為NA
C.標準狀況下,aL氧氣和氮氣的混合物含有的分子數約為![]() ×6.02×1023個
×6.02×1023個
D.常溫常壓下,11.2 L CO分子數是0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨在工農業生產中應用廣泛。在壓強為30MPa時,不同溫度時合成氨平衡混合氣體中NH3的體積分數如下:
溫度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
請回答:
(1)根據圖中所示,合成氨的熱化學方程式為___。
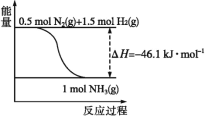
(2)將1molN2(g)和3molH2(g)通入一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化劑,ΔH___(填“變大”“變小”或“不變”)。
(3)已知破壞1molN≡N鍵、1molH—H鍵需要吸收的能量分別為946kJ、436kJ,則破壞1molN—H鍵需要吸收的能量為___kJ。
(4)N2H4可視為NH3分子中的一個H被—NH2取代的產物。發射衛星用N2H4(g)為燃料,以NO2為氧化劑發生反應生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
則1molN2H4與NO2完全反應的熱化學方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將200mL CuSO4和Fe2(SO4)3的混合溶液分成兩等份,向其中一份加入足量鐵粉,充分反應后測得固體質量保持不變;向另一份中加入足量BaCl2溶液,經過濾、洗滌、干燥、稱量,得到23.3g白色沉淀。請計算:
(1)原溶液中c(SO42-) = __________。
(2)原溶液中CuSO4和Fe2(SO4)3的物質的量比為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是由常見元素組成的一些單質及其化合物之間的轉化關系圖。各方框表示有關的一種反應物或生成物(部分物質已經略去)。其中A、B、D在常溫下均為無色無味的氣體,C是能使濕潤的紅色石蕊試紙變藍的氣體,M是最常見的無色液體。

(1)寫出C→E的化學方程式: 。
(2)實驗室常用加熱兩種固體混合物的方法制備物質C,其化學方程式為: ,干燥C常用 (填寫試劑名稱)。
(3)E物質遇到D物質時,會觀察到 現象,若用排水法收集F,則最終集氣瓶中收集到的氣體為 (填寫物質的化學式)。
(4)寫出A→D的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法中正確的是( )
A.0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+數為0.05NA
B.1 mol Na2O2與足量CO2和H2O充分反應,轉移的電子數無法計算
C.m g CO與N2的混合氣體中所含分子數目為![]() NA
NA
D.18 g 2H216O中含有的質子數與中子數均為10NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同學設計如圖所示的實驗裝置,通過測量反應產生的CO2和H2O的質量,來確定該混合物中各組分的質量分數。

(1)實驗步驟:
①按圖(夾持儀器未畫出)組裝好實驗裝置后,首先進行的操作是__________。
②稱取樣品,并將其放入硬質玻璃管中,稱量裝濃硫酸的洗氣瓶C的質量和裝堿石灰的U形管D的質量。
③打開活塞K1、K2,關閉K3,緩緩鼓入空氣數分鐘,其目的是________。
④關閉活塞K1、K2,打開K3,點燃酒精燈加熱至不再產生氣體。裝置B中發生反應的化學方程式為________、________。
⑤打開活塞K1,緩緩鼓入空氣數分鐘,然后拆下裝置,再次稱量洗氣瓶C的質量和U形管D的質量。
(2)關于該實驗方案,請回答下列問題。
①若加熱反應后不鼓入空氣,對測定結果的影響是_______________。
②E處干燥管中盛放的藥品是堿石灰,其作用是_____________,如果實驗中沒有該裝置,則會導致測量結果NaHCO3的質量_____________(填“偏大”“偏小”或“無影響”)。
③若樣品質量為w g,反應后C、D裝置增加的質量分別為m1g、m2g,則混合物中Na2CO3·10H2O的質量分數為________(用含w、m1、m2的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素在周期表中的相對位置如圖所示,其中Z元素原子核外電子總數是其最外層電子數的3倍。請回答下列問題:
X | Y | |
Z | W |
(1)元素Z位于周期表中第____周期____族。
(2)X、Y元素氫化物穩定性強弱順序是____(用化學式表示)。
(3)Y、Z的最高價氧化物對應水化物的酸性強弱順序是____(用化學式表示)。
(4)原子序數比Y多1的元素的一種氫化物能分解為它的另一種氫化物,此分解反應的化學方程式是____ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迷迭香酸是從蜂花屬植物中提取得到的酸性物質,其結構如圖。下列敘述正確的是( )

A.迷迭香酸屬于芳香烴
B.1mol迷迭香酸最多能和7mol氫氣發生加成反應
C.迷迭香酸可以發生水解反應、取代反應和消去反應
D.1mol迷迭香酸最多能和含5molNaOH的水溶液完全反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com