
【題目】(1)將氨氣通入水中,發生化學反應的方程式有_______;下列有關分析中正確的是_______;
A.常溫時氨氣易溶于水
B.通常情況下氨氣在水中的溶解度不大
C.溶于水的氨氣分子有少量發生電離
D.氨水中的NH3H2O可電離出少量OH-
E.氨本身具有弱堿性
F.在飽和氨水中含量最多的溶質是NH3H2O
(2)氨水有許多用途,請任寫一個用氨水制取不溶性堿的方程式_______。
【答案】NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-ADF3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl
NH4++OH-ADF3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl
【解析】
(1)氨氣和水反應生成一水合氨,一水合氨是弱堿存在電離平衡,反應的化學方程式為NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-;氨氣極易溶于水,大部分和水反應生成一水合氨,氨氣本身不能發生電離屬于非電解質,生成的一水合氨存在電離平衡電離出氫氧根離子,溶液顯堿性,氨氣本身不顯堿性,氨水溶液中含量最多的溶質主要是一水合氨,ADF正確;
NH4++OH-;氨氣極易溶于水,大部分和水反應生成一水合氨,氨氣本身不能發生電離屬于非電解質,生成的一水合氨存在電離平衡電離出氫氧根離子,溶液顯堿性,氨氣本身不顯堿性,氨水溶液中含量最多的溶質主要是一水合氨,ADF正確;
(2)氨水和氯化鋁溶液發生反應生成氫氧化鋁沉淀和氯化銨,反應的化學方程式為3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl。


科目:高中化學 來源: 題型:
【題目】乙酰苯胺是較早使用的一種解熱鎮痛藥,可由苯胺和乙酸反應制備:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性質如下表:
物質 | 熔點 | 沸點 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
實驗步驟如下:

步驟1:在50 mL圓底燒瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少許鋅粉,依照右圖裝置組裝儀器。
步驟2:控制溫度計示數約105 ℃,小火加熱回流1 h。
步驟3:趁熱將反應混合物倒入盛有100 mL冷水的燒杯中,冷卻后抽濾,洗滌,得到粗產品。
請回答下列問題:
(1)步驟1中加入鋅粉的作用是________________ 、起著沸石的作用。
(2)步驟2中控制溫度計示數約105 ℃,接引管流出的主要物質是________________,若溫度過高,會導致________________。刺形分餾柱中,由下到上,溫度逐漸________________(填“升高”、“降低”或“不變”)。
(3)步驟3中抽濾裝置所包含的儀器除減壓系統外,還有吸濾瓶、________________(填儀器名稱)。
(4)步驟3得到的粗產品可采取重結晶的方法進一步提純,操作步驟是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是檢驗氣體性質的一種實驗裝置,請回答:

(1)當X為二氧化硫氣體,Y為碳酸鈉溶液時,可觀察到有氣泡放出,此實驗現象說明二氧化硫的水溶液具有_____性。
(2)當X為二氧化硫氣體,Y為品紅溶液時,可觀察到的現象是_______,此實驗現象說明二氧化硫的水溶液具有_______性,反應后將試管中的溶液加熱煮沸一段時間,可觀察到的現象是_______。
(3)若讓你設計一個吸收尾氣的裝置,試著畫出裝置圖并注明需要的藥品_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(12分)某種含有少量FeCl2雜質的FeCl3樣品,現要測定其中鐵元素的含量。實驗采用以下步驟進行:
①準確稱量m g樣品(2~3g);
②向樣品中加入10mL 5mol/L的鹽酸,再加入蒸餾水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加熱使之完全反應;
④趁熱迅速加入濃度為10%的氨水至過量,充分攪拌,使之完全沉淀;
⑤過濾,將沉淀洗滌、灼燒、冷卻稱量,反復操作至恒重。
請根據上面的敘述回答:
(1)若稱量前,托盤天平的指針偏向標尺左方;稱量讀數時,指針剛好在標尺的中間,則所得樣品的質量 。
A.比mg多 B.比mg少 C.恰好為mg
(2)溶解樣品時要加入鹽酸,原因是 。
(3)配制250mL溶液時,除需250mL的容量瓶、燒杯外,還需用到的玻璃儀器是 。
(4)加入溴水時發生反應的離子方程式是 。
(5)若坩堝質量為W1g,坩堝與灼燒后固體的總質量是W2 g,則樣品中鐵元素的質量分數是 。
(6)若在配制250mL溶液時,所用的容量瓶沒有洗干凈。當含有下列物質時,最終會使鐵元素的測定含量(填“偏高”、“偏低”或“不變”)。
①NaCl ②Fe2(SO4)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列有關說法不正確的是 )
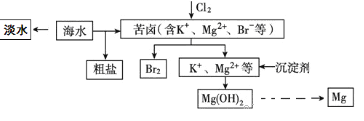
A. 海水淡化的方法主要有蒸餾法、電滲析法、離子交換法等。
B. 空氣吹出法是工業規模海水提溴的常用方法。其工藝的其中一個環節是把氯氣通入酸化的濃縮海水(或苦鹵)中。
C. 在工業上一般選用氫氧化鈉溶液作為圖示中的沉淀劑。
D. 由Mg(OH)2可以制得MgCl2·6H2O,某興趣小組同學設計了如下裝置制取無水MgCl2。其中裝置A的作用是制取干燥的HCl氣體。
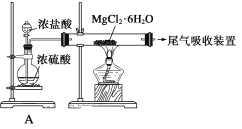
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于能量轉換的認識中不正確的是
A. 電解水生成氫氣和氧氣時,電能轉化成化學能
B. 白熾燈工作時電能全部轉變成光能
C. 電池將化學能轉化為電能
D. 煤燃燒時化學能主要轉變成熱能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現用0.1000 mol·L-1KMnO4酸性溶液滴定未知濃度的無色H2C2O4溶液,反應離子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成問題:
(1)該滴定實驗所需的玻璃儀器有______________。(填字母)
A.酸式滴定管B.堿式滴定管 C.量筒 D.錐形瓶 E.鐵架臺F.滴定管夾G.燒杯H.白紙 I.漏斗
(2)不用________(填“酸”或“堿”)式滴定管盛放高錳酸鉀溶液。試分析原因___________________________________________。
(3)滴定終點的現象為___________________________________。
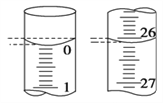
(4)若滴定開始和結束時,滴定管中的液面如圖所示,則起始讀數為________mL,終點讀數為________mL。
(5)某學生根據3次實驗分別記錄有關數據如下表:
滴定 次數 | 待測H2C2O4溶液的體積/mL | 0.1000 mol/L KMnO4的體積(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依據上表數據列式計算該H2C2O4溶液的物質的量濃度為_______________。
(6)下列操作中可能使測定結果偏低的是___________(填字母)。
A.酸式滴定管未用標準液潤洗就直接注入KMnO4標準液
B.滴定前盛放草酸溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管尖嘴部分在滴定前沒有氣泡,滴定后有氣泡
D.讀取KMnO4標準液時,開始仰視讀數,滴定結束時俯視讀數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com