
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的體積/mL | 0.01mol/L Na2SO3溶液 的體積/mL | H2O 的體積 /mL | 實驗溫 度/℃ | 溶液出現 藍色時所 需時間/s | |
| 實驗1 | 5 | V1 | 35 | 25 | |
| 實驗2 | 5 | 5 | 40 | 25 | |
| 實驗3 | 5 | 5 | V2 | 0 |
分析 (1)P的原子序數為15,原子結構中有3個電子層,最外層電子數為5;
(2)P元素的化合價由+5價降低為0,以此計算轉移電子;
(3)由2S2O32-+I2═S4O62-+2I-可知,維生素C消耗的碘為aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,結合C6H8O6+I2═C6H6O6+2H++2I-計算維生素C的物質的量;
(4)通過分析表中的數據可知,該實驗研究的是溫度、濃度對反應速率的影響;由于實驗1和實驗2的溫度相同,故實驗2與實驗3的溶液的濃度一定相同.
解答 解:(1)P的原子序數為15,原子結構中有3個電子層,最外層電子數為5,原子結構示意圖為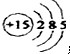 ,故答案為:
,故答案為: ;
;
(2)P元素的化合價由+5價降低為0,每生成1mol P4時,轉移電子為1mol×4×(5-0)=20mol,故答案為:20;
(3)由2S2O32-+I2═S4O62-+2I-可知,維生素C消耗的碘為aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,
由C6H8O6+I2═C6H6O6+2H++2I-可知維生素C與碘的物質的量相同,則維生素C的物質的量為$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$mol,
故答案為:$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$;
(4)實驗1和實驗2探究該反應速率與亞硫酸鈉溶液濃度的關系,實驗2和實驗3探究該反應速率與溫度的關系;由實驗2可以看出混合液的總體積為50mL,V1為10mL,V2為40mL,實驗1和實驗2可知實驗目的是探究該反應速率與亞硫酸鈉溶液濃度的關系;實驗2和實驗3可知實驗目的是探究該反應速率與溫度的關系,
故答案為:探究溫度、亞硫酸鈉溶液濃度與該反應速率的關系;40.
點評 本題考查氧化還原反應及計算、探究影響化學反應速率的因素,為高頻考點,把握反應中元素的化合價變化及反應中物質的量關系、對比實驗中條件的統一,培養學生分析問題、解決問題能力,題目難度不大.


 名師金手指領銜課時系列答案
名師金手指領銜課時系列答案科目:高中化學 來源: 題型:選擇題
| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
 如圖所示進行實驗:S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2.已知集氣瓶的容積為150mL.氧氣的密度為1.4g/L,為了節約藥品.理論上所取硫的質量不能超過多少克?(要寫過程,計算結果保留兩位小數)
如圖所示進行實驗:S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2.已知集氣瓶的容積為150mL.氧氣的密度為1.4g/L,為了節約藥品.理論上所取硫的質量不能超過多少克?(要寫過程,計算結果保留兩位小數)查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
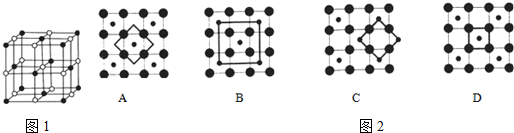
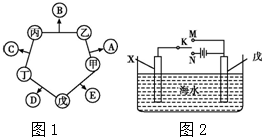 甲、乙、丙、丁、戊五種單質在一定條件下反應生成A、B、C、D、E五種化合物,其轉化關系如圖1所示.又知:①甲、乙、丙、丁均為前三周期元素的單質,常溫下均為氣態,丙、丁是空氣的主要成分,戊是應用最廣泛的金屬.②乙在甲中
甲、乙、丙、丁、戊五種單質在一定條件下反應生成A、B、C、D、E五種化合物,其轉化關系如圖1所示.又知:①甲、乙、丙、丁均為前三周期元素的單質,常溫下均為氣態,丙、丁是空氣的主要成分,戊是應用最廣泛的金屬.②乙在甲中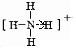 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 強電解質 | 弱電解質 | 酸性氧化物 | 堿性氧化物 | |
| A | H2SO4 | CH3COOH | NO2 | Na2O |
| B | BaSO4 | HClO | Mn2O7 | CaO |
| C | NaCl | 氨水 | SO2 | MnO2 |
| D | HI | HF | CO2 | Fe3O4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用試管取出試劑瓶中的Na2CO3溶液,發現取量過多,為了不浪費,又把過量的試劑倒入試劑瓶中 | |
| B. | Ba(NO3)2溶于水,可將含有Ba(NO3)2的廢液倒入水槽中,再用水沖入下水道 | |
| C. | 用濃硫酸配制一定物質的量濃度的稀硫酸時,濃硫酸溶于水后,應冷卻至室溫才能轉移到容量瓶中 | |
| D. | 用蒸發方法使NaCl從溶液中析出時,應將蒸發皿中NaCl溶液全部加熱蒸干 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com