
| A. | 醋酸能與水任意比例互溶 | |
| B. | 醋酸溶液的導電能力比鹽酸弱 | |
| C. | 醋酸溶液中存在醋酸根離子、氫離子 | |
| D. | 常溫下,1 mol•L-1的醋酸中c(H+)約為0.01 mol•L-1 |
分析 強弱電解質的本質區別是電離程度,只有部分電離的電極是弱電解質,可以根據一定濃度溶液的pH、醋酸鈉溶液的酸堿性等判斷醋酸是弱電解質,據此分析解答.
解答 解:A、能否溶于水與電解質強弱無關,故A錯誤;
B、導電能力強弱與離子濃度大小有關,與電解質的強弱無關,故B錯誤;
C、醋酸溶液中存在醋酸根離子、氫離子,說明醋酸發生了電離,其電離程度不知道,無法判斷電解質的強弱,故C錯誤;
D、常溫下1mol.L-1醋酸溶液的c(H+)約為0.01mol•L-1,氫離子濃度小于醋酸濃度,說明醋酸部分電離,則證明醋酸是弱電解質,故D正確;
故選D.
點評 本題考查弱電解質的判斷,明確強弱電解質的概念是解本題關鍵,注意不能根據電解質溶液導電性、物質的溶解性、化合物類型等判斷強弱電解質,注意電解質溶液導電性與離子濃度有關,與電解質強弱無關,為易錯點.


 七彩題卡口算應用一點通系列答案
七彩題卡口算應用一點通系列答案科目:高中化學 來源: 題型:解答題
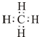 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溴乙烷與氫氧化鈉的醇溶液共熱:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O | |
| B. | 用銀氨溶液檢驗乙醛中的官能團:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加熱}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚鈉溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 甘氨酸與氫氧化鈉溶液反應:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該有機物的化學式為C11H12OCl2 | |
| B. | 在同一平面上的碳原子數最多為10個 | |
| C. | 與NaOH醇溶液在加熱條件下消去氯原子 | |
| D. | 在銅作催化劑和加熱條件下能被O2氧化成醛 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑤ | B. | ①② | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com