
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; KClO3+2KClO+7KCl+5H2O,該反應中氧化劑和還原劑的物質的量之比為7:3,
KClO3+2KClO+7KCl+5H2O,該反應中氧化劑和還原劑的物質的量之比為7:3,

 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:閱讀理解

| 實驗現象 | 原因 |
| 溶液最初從紫色逐漸變為 紅 紅 色 |
氯氣與水反應生成的酸電離出的H+使石蕊變色 氯氣與水反應生成的酸電離出的H+使石蕊變色 |
| 隨后溶液逐漸變為無色 | 氯氣與水反應生成的次氯酸具有強氧化性將其漂白褪色 氯氣與水反應生成的次氯酸具有強氧化性將其漂白褪色 |
查看答案和解析>>
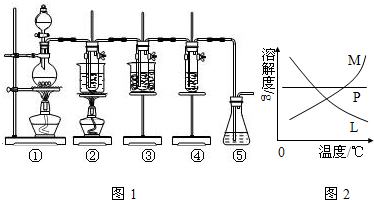
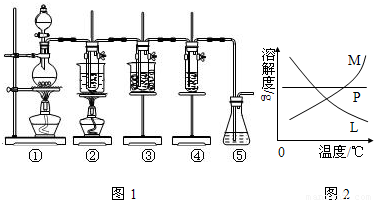
科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
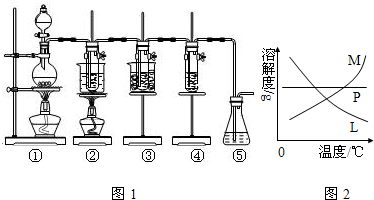
科目:高中化學 來源:不詳 題型:問答題
查看答案和解析>>
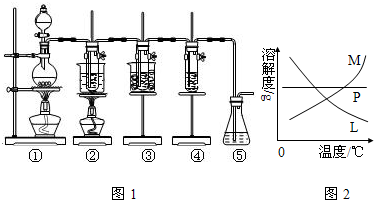
科目:高中化學 來源:2011-2012學年浙江省杭州市七校聯考高一(上)期中化學試卷(解析版) 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com