
甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系。
甲+乙 丙+丁
丙+丁
(1)轉化關系中所涉及的反應甲和乙為非氧化還原反應,且乙為水。 若甲為固體,甲和乙反應生成的丙和丁是二種弱堿。則甲的化學式是 。
(2)轉化關系中所涉及的反應為氧化還原反應,且乙為水。
① 若甲和丙是同主族元素組成的單質,且組成甲的元素位于第三周期,此反應的離子方程式是 。
② 若丙和丁都可在一定條件下還原CuO,甲+乙 丙+丁
丙+丁
寫出該反應的化學方程式: 。
③ 若甲是由N和O元素組成的氣態紅棕色物質。將3.36 g Fe加到一定量丙稀溶
液中,收集到1.12 L氣體丁(已折算為標準狀況),則反應的離子方程式是:
。
(8分,每空2分)(1)Mg3N2 (2)①2Na+2H2O = 2Na++2OH-+H2↑
②C(s)+H2O(g)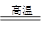 CO(g)+H2(g)③6Fe+2H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O
CO(g)+H2(g)③6Fe+2H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O
【解析】
試題分析:(1)由于甲和乙反應生成的丙和丁是二種弱堿,所以符合條件的是氮化鎂,化學式是Mg3N2,和水反應生成氨氣和氫氧化鎂。
(2)① 若甲和丙是同主族元素組成的單質,且組成甲的元素位于第三周期,則甲應該是鈉,反應的離子方程式是2Na+2H2O = 2Na++2OH-+H2↑。
② 若丙和丁都可在一定條件下還原CuO,則該反應應該是制備水煤氣的反應,方程式是C(s)+H2O(g)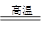 CO(g)+H2(g)。
CO(g)+H2(g)。
③甲是由N和O元素組成的氣態紅棕色物質,則甲是NO2。NO2溶于水生成NO和硝酸,這說明丙是硝酸。3.36鐵的物質的量是0.06mol。稀硝酸的還原產物是NO,則NO的物質的量是0.05mol,因此反應中轉移0.05mol×3=0.15mol電子。設生成的亞鐵離子和鐵離子的物質的量分別是x和y,則x+y=0.06mol、2x+3y=0.15mol。解得x=y=0.03mol,所以該反應的離子方程式是6Fe+20H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O。
考點:考查元素及其化合物轉化的有關判斷、氧化還原反應的計算以及方程式的書寫
點評:該題是中等難度的試題,試題基礎性強,難易適中。該題在注重對學生基礎性棕色鞏固與檢驗的同時,側重對學生能力的培養和解題方法的指導。該題最關鍵的是尋找“突破口”,“突破口”就是抓“特”字,例如特殊顏色、特殊狀態、特殊氣味、特殊反應、特殊現象、特殊制法、特殊用途等。


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案科目:高中化學 來源: 題型:
 (2011?懷柔區模擬)甲、乙、丙、丁是由短周期元素組成的物質,反應如下:甲+乙→丙+丁
(2011?懷柔區模擬)甲、乙、丙、丁是由短周期元素組成的物質,反應如下:甲+乙→丙+丁| 2 | 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.
甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2010?西城區一模)甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.甲+乙→丙+丁
(2010?西城區一模)甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.甲+乙→丙+丁

| ||
| ||
| 2 |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 甲、乙、丙、丁是由短周期元素組成的四種物質,它們之間存在如下轉化關系:甲+乙→丙+丁
甲、乙、丙、丁是由短周期元素組成的四種物質,它們之間存在如下轉化關系:甲+乙→丙+丁| 2 | 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系。甲+乙![]() 丙+丁
丙+丁
(1)轉化關系中所涉及的反應為非氧化還原反應,且乙為水。
① 若甲為塊狀固體,丙為可燃性氣體,其分子內既含有極性鍵又含有非極性鍵。則丙的電子式是 。
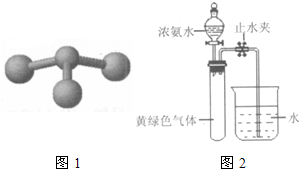
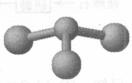
②若甲是由N和Cl元素組成的化合物,其分子結構模型如右圖所示,丙具有漂白性。則甲中Cl元素的化合價是 。
(2)轉化關系中所涉及的反應為氧化還原反應,且乙為水。
① 若甲和丙是同主族元素組成的單質,且組成甲的元素位于第三周期,此反應的離子方程式是 。
② 若丙和丁都可在一定條件下還原![]() ,此反應的化學方程式是 。
,此反應的化學方程式是 。
③ 若甲是由N和O元素組成的氣態物質,呈紅棕色。將3.36 g![]() 加到一定量丙溶液中,收集到1.12 L氣體丁(已折算為標準狀況),則反應的離子方程式是 。
加到一定量丙溶液中,收集到1.12 L氣體丁(已折算為標準狀況),則反應的離子方程式是 。
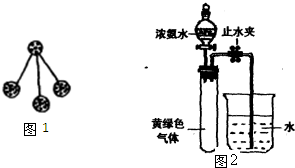
(3)Hofmann依據上述轉化關系測定氨分子的組成。現用如右圖所示的裝置進行實驗,打開分液漏斗的活塞,滴下濃氨水,至不再反應為止;關閉分液漏斗的活塞,待恢復到室溫,打開止水夾,試管內液面上升至![]() 處。
處。
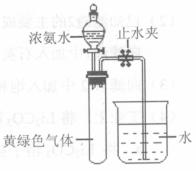
① 滴下濃氨水一段時間后,試管內發生反應的化學方程式是 。
② 證明試管內“不再反應”的實驗操作和現象是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com