
| A. | SO2可用于漂白紙漿 | B. | SiO2是良好的半導體材料 | ||
| C. | Na2O2可用作潛水艇O2來源 | D. | Cl2可用于消毒和制造漂白粉 |
科目:高中化學 來源: 題型:選擇題
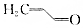 .則與鍵線式為
.則與鍵線式為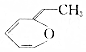 的物質互為同分異構體的是( )
的物質互為同分異構體的是( )| A. |  | B. |  | C. | 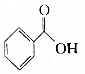 | D. | 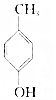 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知CH3OH(l)的燃燒熱為238.6 kJ•mol-1,則CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 鋼鐵水閘可用犧牲陽極或外加電流的陰極保護法防止其腐蝕 | |
| C. | 反應H2+Cl2═2HCl(△H<0)的機理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),則反應①的活化能小于反應②的活化能 | |
| D. | 一定條件下反應N2+3H2?2NH3達到平衡時,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
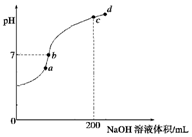 已知,常溫下H2S、H2CO3的電離常數如表
已知,常溫下H2S、H2CO3的電離常數如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
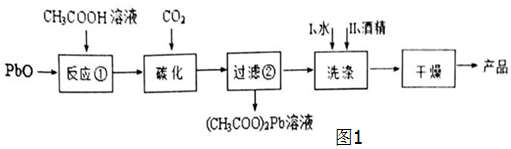
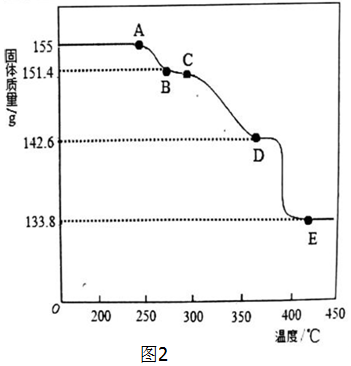
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分類是學習和研究化學物質及其變化的一種常用方法 | |
| B. | 有些液態膠體也是透明的,用肉眼很難與溶液相區別 | |
| C. | 2 L1 mol/L Na2 CO3溶液中c(Na+)為4 mol/L | |
| D. | 從1 LNaCl溶液中取出100 ml,其濃度與原1L溶液相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com